常見細胞內鈣離子檢測方法工具及其應用

準確地檢測和分析細胞內或組織中的鈣離子濃度變化,對于深入理解各種生理和病理過程具有極其重要的意義[1]。細胞內鈣離子的常見檢測方法主要有鈣離子選擇性微電極測定法、同位素示蹤法、核磁共振法、熒光探針法等。
鈣離子選擇性微電極測定法在檢測過程中不需要使用指示劑,但在穿刺細胞時可能會造成損傷,進而引發滲漏問題。同位素示蹤法雖然具有較高的靈敏度,卻對靜息狀態下的 Ca2+ 水平不敏感,并且存在一定的放射性影響。核磁共振法雖能在接近生理狀態下檢測 Ca2+ 的變化,但其成本較高。相比之下,熒光探針法目前是檢測細胞內鈣離子分布及變化情況的最廣泛應用的方法。
Section.02
常見的鈣離子探針

自上個世紀 Roger Tsien 團隊開發出第一款鈣離子熒光探針以來[2],經過幾十年的發展,市場上出現了眾多種類的鈣離子探針,目前已有許多商業化的鈣離子探針。其中,最常用的鈣離子探針包括 Fluo-4 AM、Fluo-3 AM、Rhod-2 AM 和 Fura-2 AM 等。接下來,讓我們逐一探討這些鈣離子探針的具體應用。
常用的 Ca2+ 熒光探針根據波長的不同,分為可見光激發 Ca2+ 熒光探針和紫外光激發 Ca2+ 熒光探針兩大類。
可見光激發 Ca2+ 熒光探針
與紫外光激發的熒光探針相比,可見光激發 Ca2+ 探針具有以下特點:
1)適用于大多數的激光共聚焦測鈣系統,包括共聚焦激發掃描顯微鏡以及流式細胞儀等。
2)具有更強的染料吸收性能,使得更低濃度的探針即可成功檢測 Ca2+ 變化,從而降低了對活細胞的光毒性。
3)Ca2+ 依賴性熒光強度增強,對 Ca2+ 變化水平檢測敏感度更高。
4)降低樣品自熒光以及光散射的干擾。
5)兼容光激活探針以及 UV- 激發試劑,因此更方便于多參數檢測。
6)無光譜偏移。
Fluo-3, AM
Fluo-3, AM (HY-D0716) 是一種常用的檢測細胞內鈣離子濃度的熒光探針。它穿透細胞膜進入細胞后被細胞內的酯酶剪切形成 Fluo-3,從而被滯留在細胞內。Fluo-3 游離配體幾乎是非熒光性的,但與鈣離子結合后熒光顯著增強,熒光增加可達 60 至 80 倍。激發波長為 506 nm,發射波長為 526 nm。實際檢測時推薦使用的激發波長為 488 nm 左右,發射波長為 525~530 nm。
MCE 客戶驗證
MBP 處理降低了 Ca2+ 信號傳導,此現象可以被 XBP1 敲低逆轉。
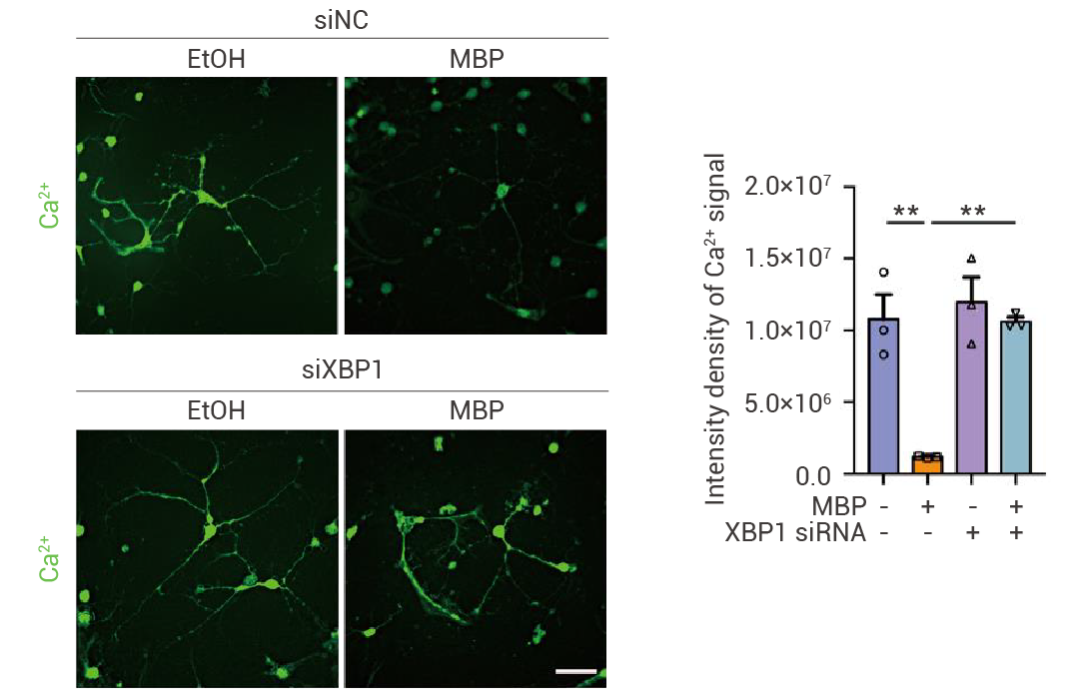
 圖 1. 使用 Fluo-3AM 染料測量神經元 Ca2+ 信號[3]。
圖 1. 使用 Fluo-3AM 染料測量神經元 Ca2+ 信號[3]。
EtOH :溶劑對照;MBP:鄰苯二甲酸單丁酯。
Fluo-4, AM
Fluo-4 AM (HY-101896) 是 Fluo-3, AM 的升級版,熒光比 Fluo-3 更亮。Fluo-4, AM 分子上的兩個氯原子被氟取代,這種結構上的微小變化其可以加載更快并且在相同條件下熒光更加明亮。它同樣可以穿透細胞膜并在細胞內被酯酶剪切形成 Fluo-4。Fluo-4 的激發波長為 494 nm,發射波長為 516 nm。Fluo-4, AM 適用于熒光顯微鏡和熒光酶標儀等檢測手段。
MCE 客戶驗證
檢測發現,US + MBs 處理使永生化人腦微血管內皮細胞 (HCMEC/D3) 細胞質中的 Ca2+ 水平上升,同時這種現象可以被抗壞血酸拮抗。
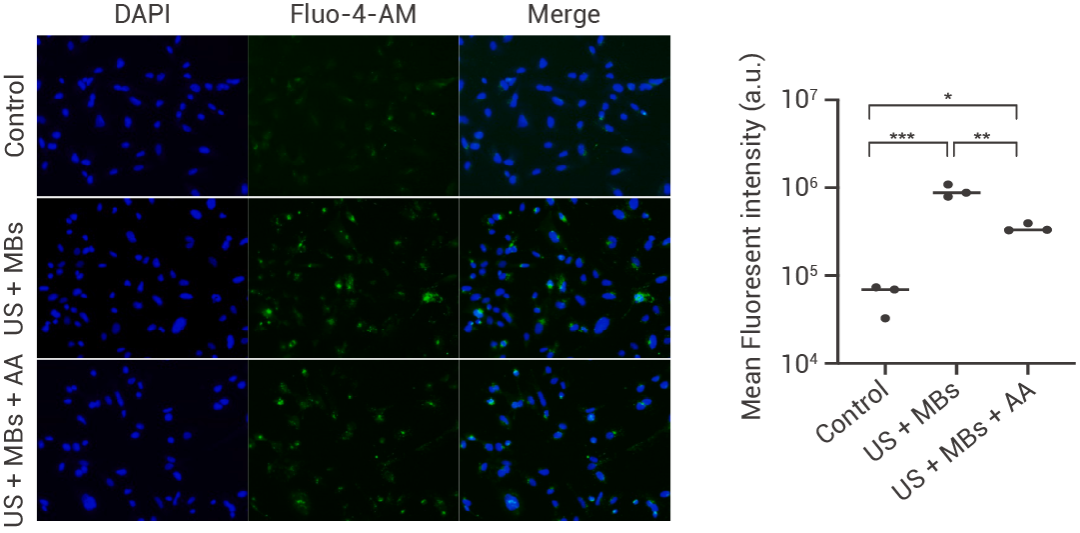
 圖 2. 通過 Fluo-4, AM 熒光探針檢測細胞中的 Ca2+ 信號[4]。
圖 2. 通過 Fluo-4, AM 熒光探針檢測細胞中的 Ca2+ 信號[4]。
US + MBs:超聲和微泡處理;AA:抗壞血酸
Rhod-2 AM
Rhod-2 AM (HY-D0989), 羅丹明 123 (Rhodamine 123, Rh-123) 的行生產物,是一種高親和力的可見光激發波長 Ca2+ 熒光探針,波長明顯長于 Fluo-3 或 Fluo-4,其與 Ca2+ 結合后的大激發波長為 550 nm,發射波長為 578 nm,此探針更適用于具有高水平自熒光信號的細胞或組織 Ca2+ 水平檢測,也可用來檢測由光感受器和籠鎖鈣離子螯合劑光激活導致的鈣離子釋放。同時由于其正電荷特性,會特異性聚集在線粒體里,由此可以與 Rhodamine 123 聯合使用用于測定線粒體內鈣離子水平。
MCE 客戶驗證
Rh-123 的綠色熒光表示線粒體正常,其強度隨膜損傷而降低,而 Rhod-2 AM 的紅色熒光表示線粒體 Ca2+ 水平,發現經 F/G/H-GNC 處理的細胞熒光從綠色變為紅色,表明線粒體完整性受損,鈣穩態被破壞。
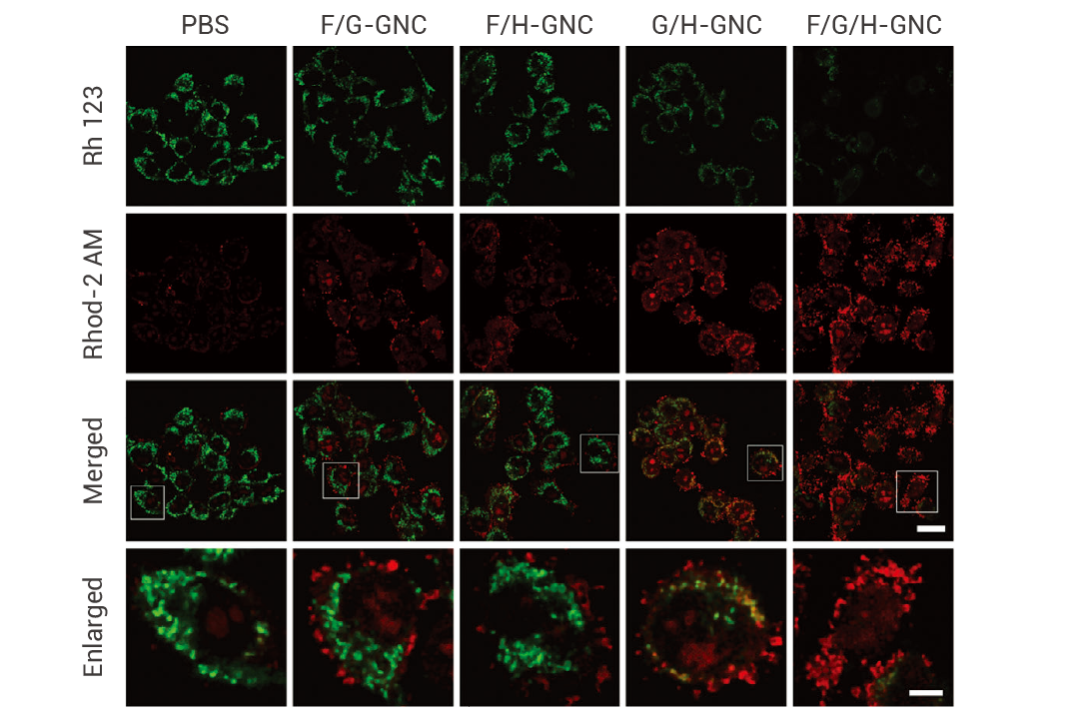
 圖 3. Rh - 123 和 Rhod-2 AM 對 4T1 細胞進行線粒體內鈣離子水平檢測[5]。
圖 3. Rh - 123 和 Rhod-2 AM 對 4T1 細胞進行線粒體內鈣離子水平檢測[5]。
F/G/H-GNC:CL 供體 (魯米諾) 和受體 (TMPyP4) 通過 pH 依賴性拆卸/重組方法加載到 AFn 中,然后礦化 AFn 形成 FLC。隨后,使用界面限制溶膠-凝膠法將 FLC、GOx 和 Hb 定量共封裝在納米反應器內。為了能夠按需激活催化活性,最后使用 AS1411 混合物覆蓋納米反應器,形成的三種 DNA 開關。
Mag-Fluo-4 AM
Mag-Fluo-4 AM (HY-D1498) 是一種 Fluo-4 的類似物,具有獨特的鈣和鎂離子檢測特性。它對 Mg2+ 的結合親和力(Kd)為 4.7 mM,而對 Ca2+ 的 Kd 為 22 µM,因此可以用作細胞內鎂離子的指示劑以及低親和力的鈣離子指示劑。
Mag-Fluo-4 AM 染料能夠特異性地被內質網捕獲,因此非常適合檢測內質網內游離鈣離子濃度的變化。在熒光酶標儀下,Mag-Fluo-4 AM 的激發波長為 490 nm,發射波長為 525 nm。
紫外光激發 Ca2+ 熒光探針
Fura-2 AM 和 Indo-1 AM 均屬于可見光激發的鈣離子熒光指示劑,是目前常用的比率測量熒光探針。
1)與第一代染料 Quin-2 相比,Fura-2 和 Indo-1 具有更強的熒光發射,并且在生理 pH 范圍內對 pH 變化不敏感。這一特性使得它們在多種實驗條件下仍能保持穩定的讀數。
2)Fura-2 和 Indo-1 對鈣離子 (Ca2+) 具有更高的選擇性,相比于二價金屬離子如鎂 (Mg2+)、鋅 (Zn2+)、錳 (Mn2+)、鐵 (Fe2+) 等,它們對 Ca2+ 的親和力更強。
3)作為雙波長熒光染料,Fura-2 和 Indo-1 在標定 Ca2+ 濃度時并不僅僅依賴于熒光強度的變化,而是通過比較不同波長下的熒光比率來實現。這一比率測量的方法大大提高了結果的準確性和可重復性。
Fura-2 AM
Fura-2 AM (HY-101897) 是紫外光激發的比值型或雙波長熒光染料,其激發特性與 Ca2+ 濃度有關,當介質中沒有 Ca2+ 時,其激發峰為 380 nm,當與鈣結合時,激發峰向短波方向 340 nm 處移動,最后分別以 340 nm、380 nm 激發得到發射光的比例,這種比例與細胞內 Ca2+ 濃度成正比例的關系。發射光譜在 530 nm 處測量[6]。
比率型熒光探針減少了染料負載導致的指示不均勻、不良的染料保留和光漂白的影響。另外 Fura-2 還具有較強的抗熒光淬滅能力,在熒光顯微鏡或其它熒光檢測設備上可以連續檢測較長時間,也不會明顯影響其熒光效果。
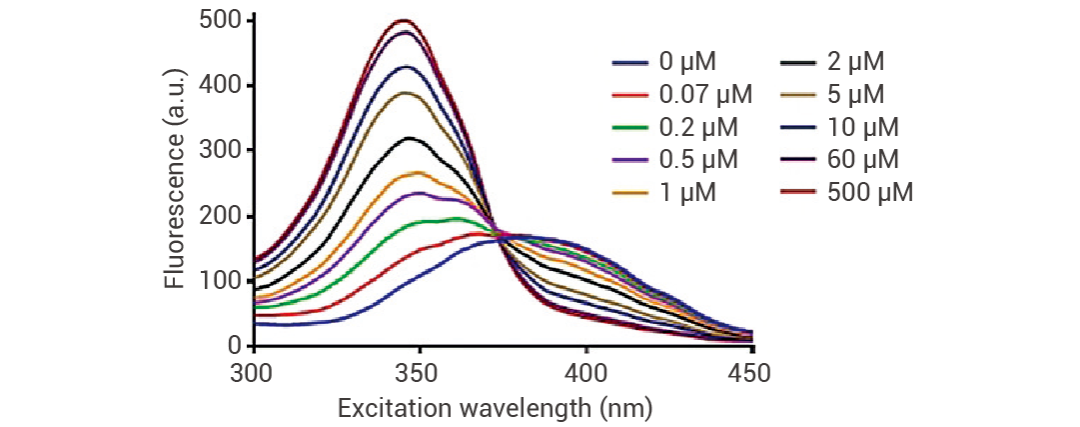 圖 4. 發射光譜在 530 nm 處測量不同鈣離子濃度時 Fura-2 的激發光譜的情況[6]。
圖 4. 發射光譜在 530 nm 處測量不同鈣離子濃度時 Fura-2 的激發光譜的情況[6]。
Section.03
實驗小貼士

以 Fluo-4 或 Fluo-4 AM 為例,常規的熒光探針如 Fluo-4 本身是一種極性較大的酸性化合物,無法直接進入細胞內。如果需要進行細胞內染色,通常需要借助膜片微電極 (patch pipette)、顯微注射 (microinjection) 或胞引作用等方法來輔助藥物的加載,這些過程往往繁瑣且復雜。
為了解決這一問題,Fluo-4 的負性基團上結合了乙酰氧甲酯 (AM)。這一簡單的化學改造不僅提高了其脂溶性,還消除了負電荷,從而顯著增強了其細胞滲透性。研究者只需將細胞孵育在含有 Fluo-4 AM 的培養液中,就可以輕松實現探針的加載,省去了許多麻煩的步驟。
一旦 Fluo-4 AM 進入細胞后,細胞內的酯酶會對其進行水解,恢復為 Fluo-4 形式,使其能夠在細胞內正常發揮生理功能。通過這種方法,熒光探針的應用變得更為簡便與高效。
檢測鈣離子時,是否需要加入丙磺舒?
丙磺舒 (Probenecid) 是一種細胞膜中有機陰離子轉運蛋白的抑制劑。當帶有AM基團的鈣離子熒光探針進入細胞后,會被細胞內的酯酶水解成帶負電荷的形式,準備與鈣離子結合。然而,一些細胞系中存在陰離子轉運蛋白,這些蛋白會將已經轉化為負電荷形式的鈣離子熒光探針運輸到細胞膜外。當加入丙磺舒后,它會抑制這些陰離子轉運蛋白的功能,從而防止探針的外泄,使得探針能夠在細胞內充分發揮作用達到百分之百的效能。
鈣離子的熒光探針可以用于植物細胞嗎?
根據文獻報道,鈣離子探針可以用于植物,在植物中比較常用的是 Fluo-4[7][8]。具體的方案方法可以參考文獻。
此外,熒光染料在保存、實驗的過程中需要注意避光操作。配制好的染色工作液必須一次使用完畢,不能凍存喔~
好啦!本期分享就到這里,有需要的小伙伴自行點贊收藏~
|
產品推薦 |
|
常見的細胞質 Ca2+ 探針 |
|
常見的細胞質 Ca2+ 探針,是 Fluo-3 AM 的升級版 |
|
線粒體 Ca2+ 探針 |
|
內質網 Ca2+ 探針 |
|
常見的比率型細胞質 Ca2+ 探針 |
|
有機陰離子轉運蛋白的抑制劑 |
|
膽堿能 (cholinergic) 激動劑,可引起細胞外的 Ca2+ 內流 |

[1] Eisner D, et al. Physiology of intracellular calcium buffering [published correction appears in Physiol Rev. 2024 Jan 1;104(1):327.
[2] Kao JP, et al. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J Biol Chem. 1989 May 15;264(14):8179-84. PMID: 2498309.
[3] Cui F, et al. Maternal phthalates exposure promotes neural stem cell differentiation into phagocytic astrocytes and synapse engulfment via IRE1α/XBP1s pathway. Cell Rep. 2025;44(1):115126.
[4] Chen J, et al. Enhanced macromolecular substance extravasation through the blood-brain barrier via acoustic bubble-cell interactions. Ultrason Sonochem. 2024;103:106768.
[5] Han W, et al. Self-Sustained Biophotocatalytic Nano-Organelle Reactors with Programmable DNA Switches for Combating Tumor Metastasis. Adv Mater. Published online January 10, 2025.
[6] Pendin D, et al. A Synthetic Fluorescent Mitochondria-Targeted Sensor for Ratiometric Imaging of Calcium in Live Cells. Angew Chem Int Ed Engl. 2019;58(29):9917-9922.
[7] Wang Y, et al. Disruption of actin filaments induces mitochondrial Ca2+ release to the cytoplasm and [Ca2+]c changes in Arabidopsis root hairs. BMC Plant Biol. 2010;10:53.
[8] Wang Y, et al. Disruption of actin filaments induces mitochondrial Ca2+ release to the cytoplasm and [Ca2+]c changes in Arabidopsis root hairs. BMC Plant Biol. 2010 Mar 24;10:53.







