解讀GMP:國(guó)產(chǎn)智能細(xì)胞計(jì)數(shù)儀CytScop的合規(guī)性
在生物制藥行業(yè)邁向精準(zhǔn)化與智能化的進(jìn)程中,細(xì)胞計(jì)數(shù)作為生產(chǎn)工藝的關(guān)鍵質(zhì)控節(jié)點(diǎn),其數(shù)據(jù)可靠性直接決定了藥品的安全性與有效性。GMP(Good Manufacturing Practice,生產(chǎn)質(zhì)量管理規(guī)范)作為全球藥品生產(chǎn)的核心標(biāo)準(zhǔn),要求從原料、設(shè)備到生產(chǎn)工藝的每個(gè)環(huán)節(jié)均需滿足質(zhì)量可控性、數(shù)據(jù)完整性和可追溯性要求。浚真生命科學(xué)自主研發(fā)的CytScop系列產(chǎn)品通過(guò)技術(shù)創(chuàng)新和法規(guī)適配,逐步打破進(jìn)口壟斷,成為GMP合規(guī)性實(shí)踐的典范。
藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)
GMP概述
GMP是由世界衛(wèi)生組織(WHO)制定的藥品生產(chǎn)質(zhì)量管理規(guī)范,旨在通過(guò)系統(tǒng)性管理降低生產(chǎn)過(guò)程中的污染、交叉污染和人為差錯(cuò)風(fēng)險(xiǎn)。中國(guó)自1988年首次引入GMP,并于2010年修訂發(fā)布《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》,強(qiáng)調(diào)數(shù)據(jù)完整性、工藝驗(yàn)證和持續(xù)監(jiān)控。
GMP的核心要求
質(zhì)量管理體系:涵蓋人員培訓(xùn)、設(shè)備驗(yàn)證、文件管理及偏差處理。
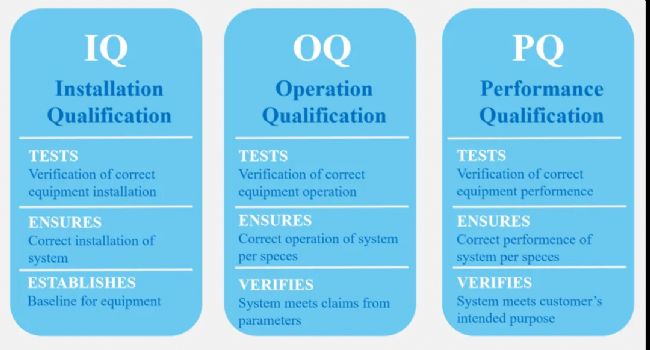
數(shù)據(jù)完整性原則:遵循ALCOA+原則(可追溯性、易讀性、同時(shí)性、原始性、準(zhǔn)確性,以及完整性、一致性、持久性、可取性)。 設(shè)備驗(yàn)證:需通過(guò)安裝確認(rèn)(IQ)、運(yùn)行確認(rèn)(OQ)、性能確認(rèn)(PQ)三大階段。
設(shè)備驗(yàn)證:需通過(guò)安裝確認(rèn)(IQ)、運(yùn)行確認(rèn)(OQ)、性能確認(rèn)(PQ)三大階段。
GMP對(duì)細(xì)胞計(jì)數(shù)儀的具體要求
校準(zhǔn)要求(2010版GMP第90-94條)
設(shè)備需定期校準(zhǔn)并記錄,校準(zhǔn)范圍需覆蓋實(shí)際使用量程。
關(guān)鍵參數(shù):如細(xì)胞濃度、活率等測(cè)量誤差需符合預(yù)設(shè)標(biāo)準(zhǔn)。
3Q驗(yàn)證要求(2010版GMP附錄11) 數(shù)據(jù)管理(2010版GMP第22條及FDA 21 CFR Part 11)
數(shù)據(jù)管理(2010版GMP第22條及FDA 21 CFR Part 11)
軟件需支持多級(jí)用戶權(quán)限(如管理員、高級(jí)用戶、普通用戶等),并記錄審計(jì)追蹤日志;數(shù)據(jù)存儲(chǔ)需采用數(shù)據(jù)庫(kù)形式,防止篡改,并支持定期備份與還原。
CytScop智能細(xì)胞計(jì)數(shù)儀的合規(guī)性實(shí)踐
技術(shù)創(chuàng)新簡(jiǎn)化檢測(cè)流程
微流控芯片技術(shù):預(yù)包埋TB或AOPI染料,實(shí)現(xiàn)樣品前處理自動(dòng)染色及混勻,減少人工誤差。
雙熒光+明場(chǎng)大視野顯微光學(xué)系統(tǒng):結(jié)合相位增強(qiáng)對(duì)比技術(shù),提升細(xì)胞形態(tài)分辨能力,滿足高靈敏度檢測(cè)需求,助力分析小細(xì)胞,兼容性強(qiáng)。
AI算法:基于卷積神經(jīng)網(wǎng)絡(luò)(CNN)的智能識(shí)別模型,自動(dòng)適應(yīng)細(xì)胞團(tuán)簇、凋亡等復(fù)雜形態(tài),避免主觀設(shè)定參數(shù)的影響。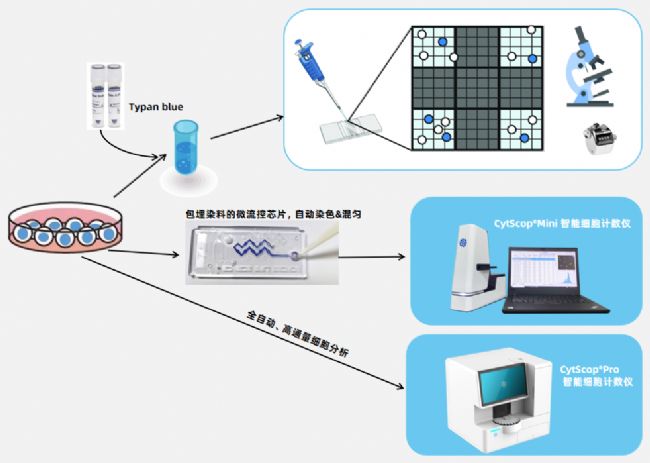
軟件與數(shù)據(jù)合規(guī)性
權(quán)限管理:多級(jí)用戶權(quán)限設(shè)置,支持電子簽名和審計(jì)追蹤功能。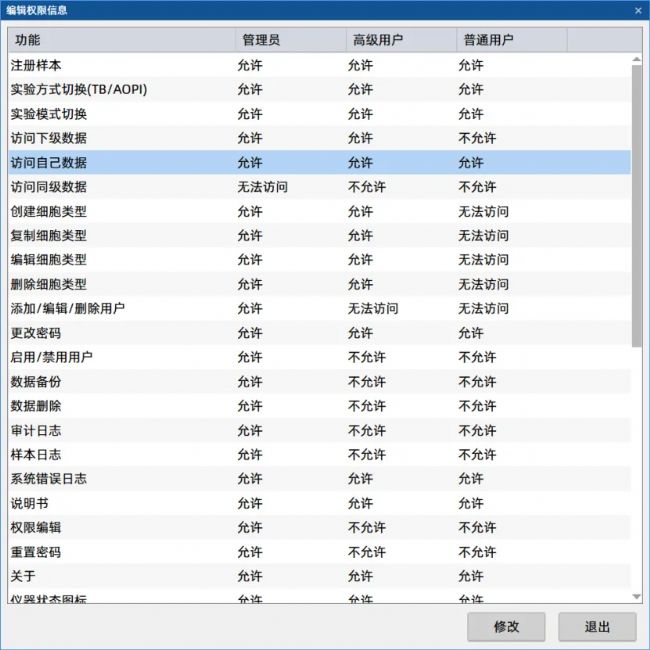 數(shù)據(jù)完整性:符合ALCOA+原則,確保數(shù)據(jù)不可篡改。
數(shù)據(jù)完整性:符合ALCOA+原則,確保數(shù)據(jù)不可篡改。
驗(yàn)證服務(wù):通過(guò)3Q認(rèn)證,采用標(biāo)準(zhǔn)微球進(jìn)行性能確認(rèn),滿足GMP附錄11要求。
實(shí)際應(yīng)用驗(yàn)證
性能測(cè)試:通過(guò)采用了ISO描述的實(shí)驗(yàn)操作方法(ISO 6887-1:2017):通過(guò)一系列倍比稀釋來(lái)設(shè)計(jì)實(shí)驗(yàn),CytScop®Pro的線性相關(guān)系數(shù)R²>0.999,重復(fù)性CV<3%,活率誤差≤3%。(詳情:《國(guó)產(chǎn)細(xì)胞計(jì)數(shù)新勢(shì)力揭秘之卓越性能》)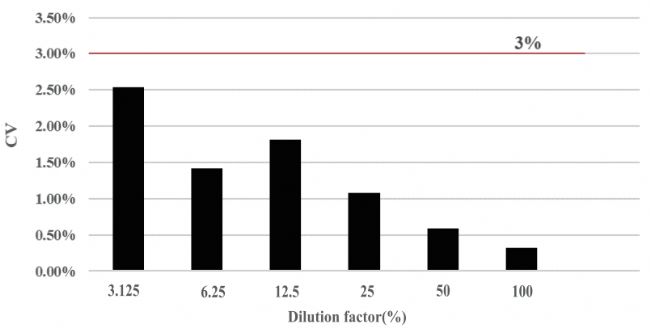
總結(jié)
細(xì)胞計(jì)數(shù)儀符合GMP合規(guī)性是保障生物制藥質(zhì)量的核心要素,涉及設(shè)備精度、數(shù)據(jù)完整性及全生命周期驗(yàn)證。CytScop®系列智能細(xì)胞計(jì)數(shù)儀不僅符合GMP及FDA 21 CFR Part 11國(guó)際標(biāo)準(zhǔn),還具備高精確性及準(zhǔn)確性檢測(cè)性能,在多臺(tái)設(shè)備一致性上實(shí)現(xiàn)突破。隨著《藥品記錄與數(shù)據(jù)管理要求》等法規(guī)的深化執(zhí)行及關(guān)鍵技術(shù)攻關(guān)”的推進(jìn),國(guó)產(chǎn)細(xì)胞計(jì)數(shù)儀將為全球生物制藥行業(yè)提供更安全、高效的工具支持。
藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)
GMP概述
GMP是由世界衛(wèi)生組織(WHO)制定的藥品生產(chǎn)質(zhì)量管理規(guī)范,旨在通過(guò)系統(tǒng)性管理降低生產(chǎn)過(guò)程中的污染、交叉污染和人為差錯(cuò)風(fēng)險(xiǎn)。中國(guó)自1988年首次引入GMP,并于2010年修訂發(fā)布《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》,強(qiáng)調(diào)數(shù)據(jù)完整性、工藝驗(yàn)證和持續(xù)監(jiān)控。
GMP的核心要求
質(zhì)量管理體系:涵蓋人員培訓(xùn)、設(shè)備驗(yàn)證、文件管理及偏差處理。
數(shù)據(jù)完整性原則:遵循ALCOA+原則(可追溯性、易讀性、同時(shí)性、原始性、準(zhǔn)確性,以及完整性、一致性、持久性、可取性)。


GMP對(duì)細(xì)胞計(jì)數(shù)儀的具體要求
校準(zhǔn)要求(2010版GMP第90-94條)
設(shè)備需定期校準(zhǔn)并記錄,校準(zhǔn)范圍需覆蓋實(shí)際使用量程。
關(guān)鍵參數(shù):如細(xì)胞濃度、活率等測(cè)量誤差需符合預(yù)設(shè)標(biāo)準(zhǔn)。
3Q驗(yàn)證要求(2010版GMP附錄11)

軟件需支持多級(jí)用戶權(quán)限(如管理員、高級(jí)用戶、普通用戶等),并記錄審計(jì)追蹤日志;數(shù)據(jù)存儲(chǔ)需采用數(shù)據(jù)庫(kù)形式,防止篡改,并支持定期備份與還原。
CytScop智能細(xì)胞計(jì)數(shù)儀的合規(guī)性實(shí)踐
技術(shù)創(chuàng)新簡(jiǎn)化檢測(cè)流程
微流控芯片技術(shù):預(yù)包埋TB或AOPI染料,實(shí)現(xiàn)樣品前處理自動(dòng)染色及混勻,減少人工誤差。
雙熒光+明場(chǎng)大視野顯微光學(xué)系統(tǒng):結(jié)合相位增強(qiáng)對(duì)比技術(shù),提升細(xì)胞形態(tài)分辨能力,滿足高靈敏度檢測(cè)需求,助力分析小細(xì)胞,兼容性強(qiáng)。
AI算法:基于卷積神經(jīng)網(wǎng)絡(luò)(CNN)的智能識(shí)別模型,自動(dòng)適應(yīng)細(xì)胞團(tuán)簇、凋亡等復(fù)雜形態(tài),避免主觀設(shè)定參數(shù)的影響。

權(quán)限管理:多級(jí)用戶權(quán)限設(shè)置,支持電子簽名和審計(jì)追蹤功能。

驗(yàn)證服務(wù):通過(guò)3Q認(rèn)證,采用標(biāo)準(zhǔn)微球進(jìn)行性能確認(rèn),滿足GMP附錄11要求。
實(shí)際應(yīng)用驗(yàn)證
性能測(cè)試:通過(guò)采用了ISO描述的實(shí)驗(yàn)操作方法(ISO 6887-1:2017):通過(guò)一系列倍比稀釋來(lái)設(shè)計(jì)實(shí)驗(yàn),CytScop®Pro的線性相關(guān)系數(shù)R²>0.999,重復(fù)性CV<3%,活率誤差≤3%。(詳情:《國(guó)產(chǎn)細(xì)胞計(jì)數(shù)新勢(shì)力揭秘之卓越性能》)

圖:各稀釋濃度下重復(fù)性CV<3%
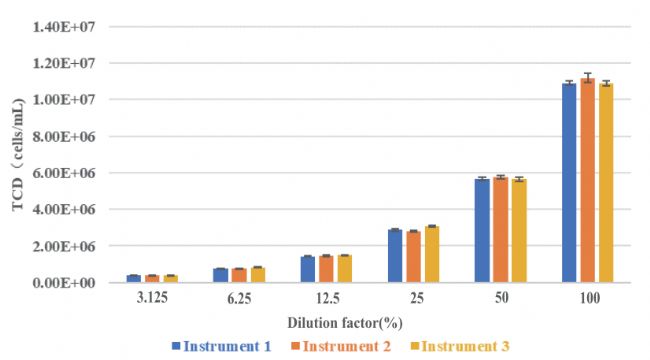
多臺(tái)一致性:通過(guò)采用了ISO描述的實(shí)驗(yàn)操作方法(ISO 6887-1:2017):通過(guò)一系列倍比稀釋來(lái)設(shè)計(jì)實(shí)驗(yàn),來(lái)檢測(cè)多臺(tái)CytScop®Pro智能細(xì)胞計(jì)數(shù)儀之間的性能一致性;測(cè)試結(jié)果無(wú)顯著性差異(P>0.05),符合GMP對(duì)儀器穩(wěn)定性的要求。(詳情: 多臺(tái)CytScop®Pro智能細(xì)胞計(jì)數(shù)儀之間的性能評(píng)價(jià))

圖:在各稀釋濃度下3臺(tái)儀器測(cè)量總細(xì)胞濃度結(jié)果對(duì)比
總結(jié)
細(xì)胞計(jì)數(shù)儀符合GMP合規(guī)性是保障生物制藥質(zhì)量的核心要素,涉及設(shè)備精度、數(shù)據(jù)完整性及全生命周期驗(yàn)證。CytScop®系列智能細(xì)胞計(jì)數(shù)儀不僅符合GMP及FDA 21 CFR Part 11國(guó)際標(biāo)準(zhǔn),還具備高精確性及準(zhǔn)確性檢測(cè)性能,在多臺(tái)設(shè)備一致性上實(shí)現(xiàn)突破。隨著《藥品記錄與數(shù)據(jù)管理要求》等法規(guī)的深化執(zhí)行及關(guān)鍵技術(shù)攻關(guān)”的推進(jìn),國(guó)產(chǎn)細(xì)胞計(jì)數(shù)儀將為全球生物制藥行業(yè)提供更安全、高效的工具支持。
標(biāo)簽:
國(guó)產(chǎn)智能細(xì)胞計(jì)數(shù)儀
GMP合規(guī)性
- 解讀GMP:國(guó)產(chǎn)智能細(xì)胞計(jì)數(shù)儀CytScop的合規(guī)性
- 細(xì)胞計(jì)數(shù)常見(jiàn)問(wèn)題及針對(duì)性解決方案:提升計(jì)數(shù)質(zhì)量、優(yōu)化實(shí)驗(yàn)流程
- 生物藥關(guān)鍵質(zhì)量屬性(CQA)監(jiān)測(cè):細(xì)胞計(jì)數(shù)精準(zhǔn)化的方法和應(yīng)用
- 《醫(yī)藥工業(yè)數(shù)智化轉(zhuǎn)型實(shí)施方案(2025—2030年)》發(fā)布
- 加速生物工藝開(kāi)發(fā)的關(guān)鍵工具:高度集成的智能化分析模塊
- 生產(chǎn)工藝 —— 《細(xì)胞治療產(chǎn)品生產(chǎn)檢查指南》要點(diǎn)解讀
- 高效精準(zhǔn)的自動(dòng)智能細(xì)胞密度檢測(cè)方法
- QbD理念驅(qū)動(dòng)生物工藝優(yōu)化,促進(jìn)細(xì)胞密度在線自動(dòng)化監(jiān)測(cè)
- 從進(jìn)口到技術(shù)領(lǐng)跑:國(guó)產(chǎn)高端智能細(xì)胞計(jì)數(shù)儀破局之道
- 艾貝泰邀您試用Countleader FL 2000細(xì)胞計(jì)數(shù)儀
- CytScop®Mini智能細(xì)胞計(jì)數(shù)儀亮相斯坦福大學(xué)
- 中國(guó)細(xì)胞與基因治療大會(huì)第五屆年會(huì)·海口招展通知
- 浚真生命邀您參加高端細(xì)胞計(jì)數(shù)儀“以租代購(gòu)”活動(dòng)
- 浚真全自動(dòng)高通量細(xì)胞計(jì)數(shù)儀助力大規(guī)模設(shè)備更新
- 瑞孚迪Cellometer™ Ascend™ 細(xì)胞計(jì)數(shù)儀新品上市
- 瑞沃德智能熒光細(xì)胞計(jì)數(shù)儀C200FL上市,搶先免費(fèi)試用
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





