文獻解讀:細胞外囊泡和脂質納米顆粒的條形碼雜交助力藥物靶向遞送
靶向藥物遞送是現代醫學的重要研究方向,通過將藥物精準輸送至病灶部位,顯著提升藥物治療效果,同時減少藥物用量、降低副作用。然而,靶向遞送系統的開發面臨諸多挑戰,包括如何在不影響健康組織的前提下將藥物遞送到特定組織或細胞,以及應對生物屏障、免疫清除、局部控制藥物釋放和在不引起不良反應的情況下保證藥物生物相容性與安全性等問題。
細胞外囊泡(EVs)因其天然的來源、優異的生物相容性、可運輸多種分子以及組織靶向性而被認為是理想的藥物遞送載體。然而,EVs 的組織特異性及來源細胞對 EVs 生物分布的影響尚未完全明確,且由于其異質性強、尺寸微小以及半衰期短,很難系統地開展針對 EVs 的生物分布和組織趨向性的研究。因此,如果有一種方式可以監測和量化體內 EVs 的生物分布,這將極大地促進該領域的發展。
2025年1月16日,阿斯利康位于瑞典的研發團隊在 Advanced Science 上發表了一篇題為“Barcoded Hybrids of Extracellular Vesicles and Lipid Nanoparticles for Multiplexed Analysis of Tissue Distribution”的研究論文。該研究開發出一種 EVs 與攜帶單鏈 DNA 條碼(DNA Barcode)的 LNPs 融合的技術,利用 DNA 條形碼作為區分不同來源 EVs 的依據,創建了獨特的帶有條形碼的雜交 EV 顆粒(hybrid EV particle, hEV)文庫,實現了在單個體內實驗中同時追蹤多種 EVs,這一方法能夠高效地獲取大量的 EVs 生物分布數據,為繪制組織趨向圖和識別潛在的組織特異性藥物遞送載體提供了有力工具,對靶向藥物遞送領域的研究具有重要意義。
一、hEVs 的綜合表征
本研究開發了一種 pH 依賴的方法,通過控制 EVs 與 LNPs 在酸性環境中融合,成功制備了 hEVs。納米顆粒跟蹤分析(NTA)顯示,EVs 粒徑平均值為 117 nm,LNPs 為 67 nm,而融合后的 hEVs 在 174 nm 處出現額外峰(圖1d),表明 EVs 與 LNPs 發生融合。透射電子顯微鏡結合免疫金標記進一步確認了 EVs 標記物 CD81 和 CD63 與 LNPs 組分 PEG 共存于同一顆粒上(圖1f)。Western blotting 對細胞、EVs 和 hEVs 樣品的蛋白質分析結果進一步證實這種 pH 依賴的方法成功制備了 hEVs。此外,利用 NanoFCM 的單分子檢測能力驗證條碼封裝效率,結果顯示,hEVs 的條碼封裝效率為 60%,而 LNPs 的封裝效率超過 98%(圖1e)。綜上所述,這些結果表明開發的 pH 依賴法能夠實現 hEVs 的合成,并通過與 LNPs 融合使其裝載 DNA 貨物。
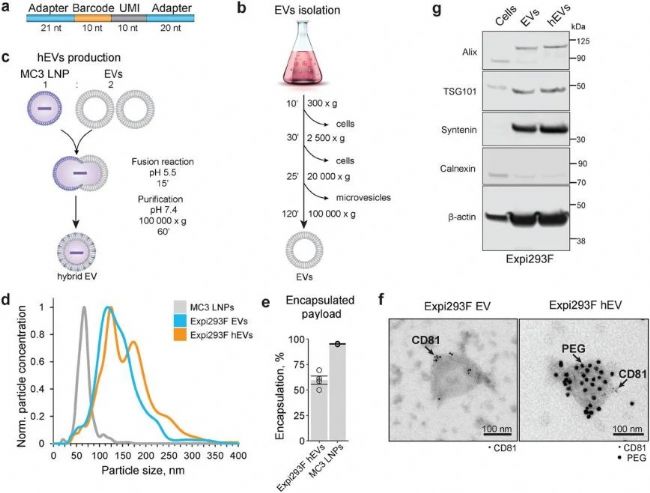
圖1. 雜交細胞外囊泡(hEVs)的形成與表征
二、不同來源 hEVs 條碼唯一性分析
研究者選取了 16 種不同細胞系(涵蓋肝、肺、胰腺、結腸、肌肉、血液、乳腺、宮頸和干細胞等,見下表),以研究 EVs 在體內的分布。通過粒徑和濃度分析,發現不同細胞系的 EVs 產量和大小存在差異,但細胞數量與 EVs 產量之間并無相關性(圖2b)。隨后,研究者對源自不同細胞系的 EVs 進行唯一條碼標記,構建了帶有獨特條碼的 hEVs 庫,并評估了 DNA 條碼的裝載效率,結果顯示不同細胞系來源的 hEVs 的 DNA 裝載效率存在很大差異(圖2d)。
進一步地,通過 NanoFCM 評估 hEVs 在存儲過程中的穩定性及相互融合的潛力。首先,用 PE-TopFluoro AF488 分別標記 Expi293F hEVs 和 HAP1 hEVs,同時在 HAP1 hEVs 中裝載 Cy5 標記的 mRNA(Cy5陽性率為35%),將 Expi293F-AF488 hEVs 和 HAP1-Cy5 hEVs 以1:1的比例混合共孵育。結果顯示,雙陽顆粒比例僅為 2.4%(圖2f, g),表明異源 hEVs 在孵育期間保持穩定。同源的 hEVs 混合后的雙陽顆粒占 7.2%(圖2f, g),這表明同類型粒子之間可能存在一些內在的相互作用。此外,基于 NanoFCM 超高的熒光靈敏度和熒光觸發模式,還發現 hEVs 中存在游離的 mRNA(圖2g),這些成分可能會吸附在未染色的顆粒上,從而導致雙陽顆粒的計數被高估。上述結果表明,hEVs 之間融合或依賴于特定類型,且在多路實驗中條碼交換的風險較低。

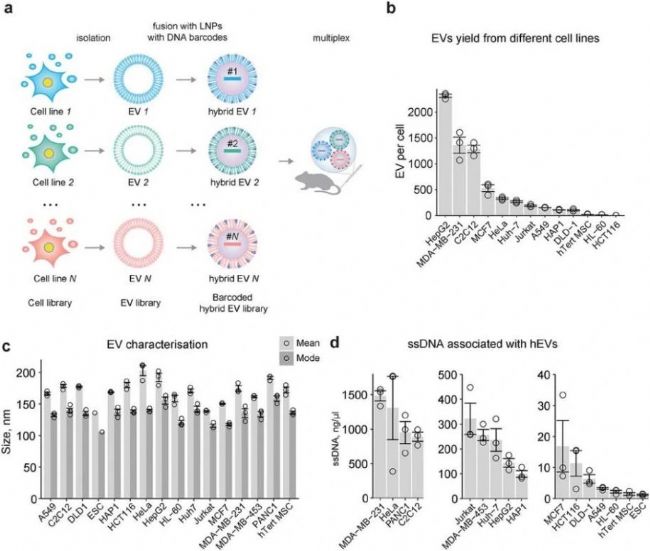
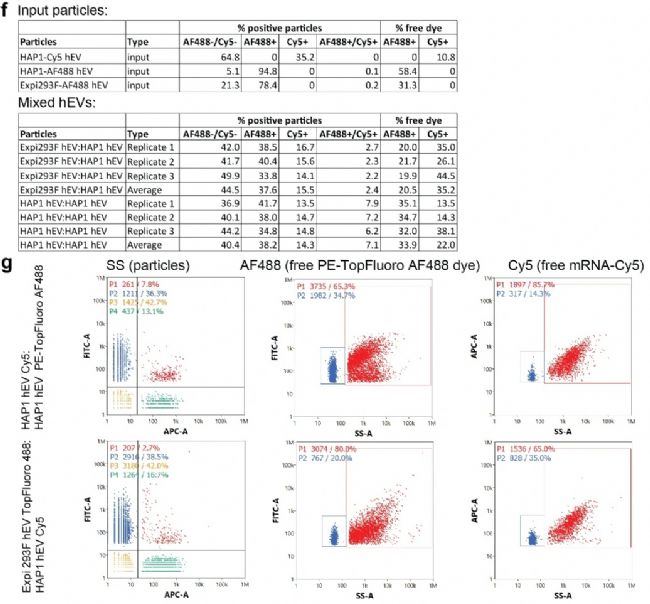
圖2. 不同細胞系 EVs 唯一條碼標記和穩定性評估
三、hEVs 的體內生物分布
為了驗證 hEVs 是否能夠實現高通量體內生物分布分析,通過尾靜脈給藥研究混合 hEVs 在小鼠體內的生物分布,給藥 1h 后根據下圖3a的均質化方法準備高通量測序分析(NGS)樣品。hEVs 體內分布顯示,肝臟是大多數顆粒富集的主要目標,而大腦和心臟組織是所有粒子最難到達的部位,說明本研究開發的方法可以快速研究 hEVs 的生物分布。值得注意的是,57% HAP1 hEVs 在肺部富集,證實 HAP1 hEVs 具有突出的肺部靶向潛力(圖3b)。
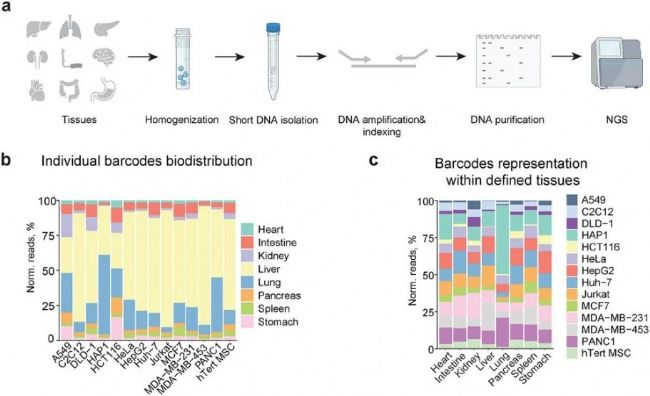
圖3. 不同來源 hEVs 的體內生物分布分析
四、hEVs 的功能性遞送
為了評估 HAP1 hEVs 在體內的遞送能力,研究者將負載 Cre mRNA 的 HAP1 hEVs 注射到 Cre 報告小鼠中,并于 4 天后通過 D-luciferin 成像檢測不同組織中的熒光素酶活性。結果顯示,在肝臟、脾臟和肺部觀察到熒光素酶活性,其中肝臟活性最高,脾臟和肺部次之(圖4e, f)。進一步的免疫組化分析表明,HAP1 hEVs 主要在肺部的亞上皮區域被細胞攝取,且未觀察到與小血管附近的細胞攝取,這表明 HAP1 hEVs 能夠離開血管并穿透肺組織(圖4g, h, i)。綜上結果表明,條碼 hEVs 可以用于快速研究 EVs 的體內分布,并有潛力成為精準靶向的藥物遞送載體。
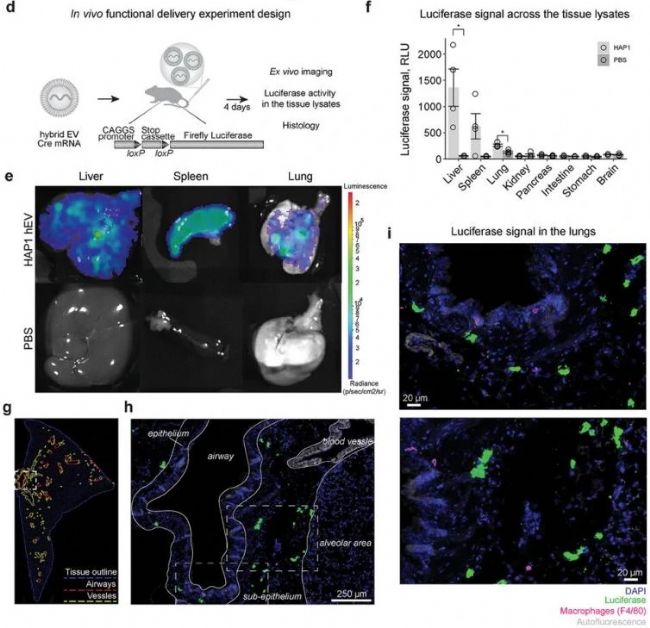
圖4. HAP1 hEVs 實現 mRNA 向肺部的功能性遞送
結論
本研究開發的條碼 hEVs 技術為 EVs 的生物分布研究提供了一種高通量、多路復用的新方法,能夠快速分析不同來源 EVs 的組織趨向性,有助于加速 EVs 作為藥物載體的研究和開發。此外,發現并證實了 HAP1 hEVs 的肺部趨向性,為開發針對肺部疾病的靶向藥物提供了新的思路和工具。該技術有望進一步優化,以提高 EVs 的靶向效率和功能性藥物的遞送能力,為個性化醫療和精準醫學提供新的策略。
展望
NanoFCM 憑借其超高靈敏度和高通量檢測能力,在單顆粒水平對 hEVs 進行了全面表征,提供包括 hEVs 的粒徑分布、濃度、裝載效率和游離核酸比例等多維信息。這些詳盡的數據為深入探究 hEVs 生物分布以及繪制組織趨向圖提供了有力支持,進而推動了 EVs 作為藥物載體的進一步開發和產業化應用。





