首次發現帶有絲氨酸的N2C GGC中度重復會誘導類似早期帕金森病的表型
在神經退行性疾病研究領域,NOTCH2NLC(N2C)基因內的GGC異常重復擴增已成為研究重點。這種異常擴增與多種神經退行性疾病相關,包括神經元核內包涵體病(NIID)、帕金森病(PD)、額顳葉癡呆(FTD)和特發性震顫(ET)。正常人的GGC重復擴增往往不超過30次,重復次數超過60次具有致病性,而許多患者的重復次數超過130次。
值得注意的是,部分患者在N2C-GGC重復擴增中表現出AGC插入(編碼絲氨酸)。一些PD患者攜帶中度的GGC擴增(41-64次),但AGC插入頻率是NIID患者的三倍,這表明GGC擴增中的AGC插入以及重復片段大小可能是導致帕金森病的原因。最近的研究表明,N2C-GGC重復序列產生的多聚甘氨酸(polyG)蛋白可能會促進神經毒性,但帶有AGC插入的中度GGC重復的功能影響仍知之甚少。
新加坡國立神經科學研究所等機構的科學家近日利用細胞模型和小鼠模型,深入探究了帶有絲氨酸的中度重復在神經退行性疾病中的潛在病理生理機制。他們首次發現這些重復序列會促進線粒體損傷和過度髓鞘化,這與早期帕金森病患者的臨床觀察結果相符。這項研究成果發表在《Molecular Neurodegeneration》期刊上。

研究材料與方法
在這項研究中,研究人員構建了帶有不同大小的N2C2 GGC重復擴增的細胞模型,并委托賽業生物構建了攜帶N2C2 GGC中度重復(帶或不帶絲氨酸插入)的轉基因小鼠模型。他們通過全細胞膜片鉗技術檢測神經元興奮性,利用RNA測序和生物信息學分析探究基因表達變化,并借助透射電鏡來觀察小鼠皮層的髓鞘結構。
技術路線
構建細胞模型來分析帶有絲氨酸的中度重復對神經變性和線粒體功能的影響
↓
構建轉基因小鼠模型來探究帶有絲氨酸的中度重復的潛在病理影響
↓
對32G13S小鼠大腦皮層的轉錄組分析表明線粒體相關通路和髓鞘成分失調
↓
通過免疫染色和透射電鏡分析確認帶有絲氨酸的中度重復誘導了過度髓鞘化
研究結果
帶有絲氨酸的中度重復在體外促進蛋白質聚集,并損害線粒體功能
研究人員推測,GGC重復大小和AGC插入的存在可能會調節神經毒性。為了探究重復序列對神經變性的影響,他們委托賽業生物合成了一系列不同的N2C2片段并構建了表達載體,包括N2C2-13G(野生型)、45G和32G13S(GGC中度重復,絲氨酸含量為28.8%,與PD患者的AGC插入比例相似)、89G和63G27S(致病性GGC重復擴增,絲氨酸含量為30%)(圖1)。
他們發現,隨著重復序列長度增加,可溶性N2C蛋白減少,不溶性N2C蛋白增加,這表明形成了不溶性N2C-polyG聚集。值得注意的是,與45G相比,32G13S表現出更多的細胞死亡,說明絲氨酸插入會加劇中度重復擴增的神經毒性。他們還發現,5-氨基乙酰丙酸(5-ALA)及其代謝產物原卟啉IX(PpIX)能有效減輕體外N2C-polyG蛋白的聚集。
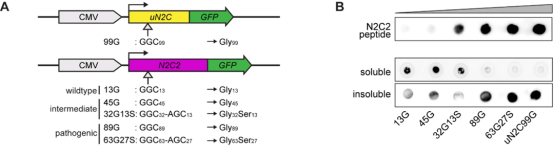
圖1. 帶有絲氨酸插入的中度重復促進蛋白質聚集
研究人員進一步推測,帶有絲氨酸插入的N2C中度重復可能會損害線粒體功能。通過測定細胞耗氧率(OCR),他們發現基礎呼吸速率隨GGC重復序列的增加而降低,而絲氨酸插入進一步破壞了基礎呼吸。此外,線粒體產生的ATP也隨重復序列的增加而減少,且絲氨酸插入進一步加劇了這種不利影響。這些結果表明,帶有絲氨酸的N2C中度重復會對線粒體功能產生不利影響,導致能量供應中斷,這種中斷與細胞死亡和神經變性有關。
帶有絲氨酸的中度重復讓小鼠表現出類似早期帕金森病的特征
為了進一步探究帶有AGC插入的N2C-polyG中度重復擴增的病理影響,研究人員委托賽業生物構建了一系列N2C-polyG轉基因小鼠品系,包括N2C-30G(低度重復)、-45G(中度重復)和-32G13S(中度重復,絲氨酸插入量為28.9%)。與N2C-30G和45G相比,32G13S小鼠顯示出更明顯的纖維狀蛋白聚集,帕金森病關鍵蛋白LRRK2升高,線粒體活性受損以及酪氨酸羥化酶(TH,多巴胺合成限速酶)水平下降,這些結果與體外實驗觀察到的線粒體功能障礙一致,也與帕金森病的臨床特征相吻合。
此外,他們還觀察到32G13S小鼠出現類似早期帕金森病的特征,包括在中腦形成纖維狀的α-突觸核蛋白聚集,以及大腦皮層和紋狀體中TH陽性神經元的減少(圖2),表明多巴胺能神經元的缺失主要發生在大腦皮層和紋狀體,而不是中腦。這些結果表明,帶有絲氨酸插入的N2C中度重復序列會加速蛋白質聚集,誘導線粒體功能障礙相關的神經毒性,并讓小鼠表現出類似早期帕金森病的特征。
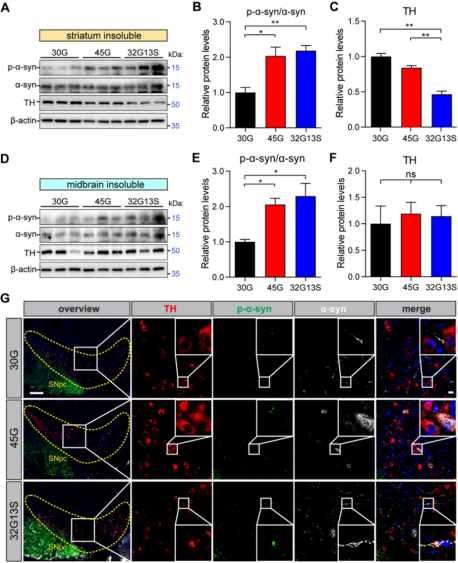
圖2. 帶有絲氨酸的中度重復表現出類似早期帕金森病的表型
通過全細胞膜片鉗分析,研究人員發現32G13S會誘導小鼠大腦皮層中的神經元過度興奮。行為測試表明,12月齡的32G13S小鼠出現了運動障礙,具體表現為在轉棒實驗中的行走時間更短,在圓筒實驗中的站立次數更少。這些數據表明,帶有絲氨酸的中度重復會觸發32G13S小鼠大腦皮層中的神經元過度興奮,并誘發小鼠的運動障礙。
帶有絲氨酸的中度重復誘導小鼠的過度髓鞘化
接下來,研究人員希望闡明與發病機制相關的潛在通路。通過比較32G13S和45G小鼠皮層的基因表達差異,他們發現32G13S小鼠的鈣離子信號通路和MAPK信號通路出現失調,而這兩條通路與線粒體功能密切相關。同時,與髓鞘成分相關的基因(包括MBP和MOG)在32G13S小鼠中出現了下調。令人驚訝的是,32G13S小鼠皮層中的MBP和MPG蛋白水平明顯提高,他們推測這是一種代償機制,通過產生髓鞘來維持重要的神經元功能和信號傳輸,以應對線粒體損傷引起的大腦皮層神經元缺失。
為了進一步證實髓鞘蛋白成分的上調,研究人員對12月齡的N2C小鼠進行免疫組化染色,發現32G13S小鼠皮層中MBP蛋白水平顯著增加。與30G和45G小鼠相比,32G13S小鼠在皮層區域表現出更多的髓鞘分支、更長的髓鞘長度、更多的髓鞘連接和更厚的髓鞘,表明32G13S小鼠皮層中存在過度髓鞘化。他們通過透射電鏡也觀察到這些現象。同時,32G13S小鼠顯示出線粒體分支較少,表明線粒體網絡受損。這些數據表明,帶有絲氨酸的中度重復可在小鼠中誘導與線粒體功能障礙有關的過度髓鞘化。
結論
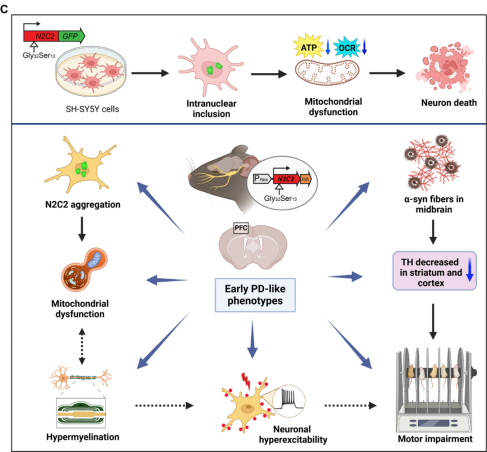
圖3. 圖文摘要
這項研究首次提供了證據,表明帶有絲氨酸的N2C-polyG中度重復可在體外促進神經毒性,并在體內誘導類似于早期帕金森病的病理生理變化(圖3)。此外,帶有絲氨酸的中度重復可誘導轉基因小鼠出現線粒體功能障礙、神經過度興奮、過度髓鞘化和運動障礙。這些發現有助于人們深入了解早期帕金森病患者的N2C-polyG中度重復的臨床意義。
原文檢索
Tu H, Yeo XY, Zhang ZW, et al. NOTCH2NLC GGC intermediate repeat with serine induces hypermyelination and early Parkinson's disease-like phenotypes in mice. Mol Neurodegener. 2024 Nov 28;19(1):91. https://doi.org/10.1186/s13024-024-00780-2





