PCR反應程序優化的方法總結
一個成熟、穩定的PCR反應成形之前必會經歷許多的坎坷,優質模板的獲取、高特異性引物的設計、反應體系各組分的優化、反應程序的優化等等。今天我們來聊聊反應程序優化的那些事兒。
首先,優質的模板是PCR成敗的前提,沒有優質的模板后續工作做得再好也是巧婦難為無米之炊。優質的模板除了濃度和純度外,模板的完整性也是一個關鍵因素。不能僅以純度(260/280、260/230的比值)來衡量模板的優劣,一定要跑個膠確認下。
例如石蠟切片核酸的提取,即使比值堪稱完美,沒有膠圖參考的情況下也不建議直接進行后續的擴增實驗,因為極易翻車。解交聯后核酸會片段化,一不注意都碎成了幾十bp的長度……那之前檢測的濃度和純度就成了擺設,一點意義也無。
再說引物的特異性,這方面常見的是去NCBI檢索現成的引物或者依靠引物設計軟件自行設計。將設計好的引物序列去基因庫比對一下,沒有重合就可以找合成公司去合成了(常用Primer 5設計引物,Oligo 7對引物進行評價。評分高的引物特異性高、引物二聚體的概率也低)。
反應體系優化這里簡單介紹一下鎂離子濃度的優化。dNTP可以結合鎂離子,被結合的鎂離子無法維持Taq酶的活性,所以鎂離子的摩爾濃度一定要比dNTP的總濃度要高。但是過高的鎂離子濃度又會增加Taq酶的錯配率,所以鎂離子的濃度是關乎擴增效果的一個重要參數。
反應程序則多集中于優化退火溫度。退火溫度常設置在引物對的Tm值附近,若想得到較高的保真率,退火溫度就略高于Tm值;若想得到較高的產物,退火溫度就略低于Tm值。教材中常用的55℃退火72℃延伸,便是因為55℃處于大多引物的Tm值附近(或略低),這一設定也許不是最適的退火溫度但一般能擴增出產物(72℃是Taq酶最適溫度)。
最后聊一下反應程序優化中經常被忽略的一個環節-變溫速率。變溫速率,尤其是變性-退火這一環節的變溫速率尤其重要。相對緩慢的變溫速率,有助于堿基嚴格按照堿基互補配對原則進行反應,這一點不論是從HRM實驗中非沃森-克里克結構的形成及消除還是DNA oligo的退火實驗都有體現,甚至可以說是極端體現。當我們實驗時遇到了熔解曲線主峰前有雜峰、測序結果套峰等不良結果時不妨把退火的降溫速率下調一些,緩一緩,或許能看到另一番風景。
最后的最后分享兩張圖:模板,反應程序、反應體系一致,只調試了退火降溫速率。
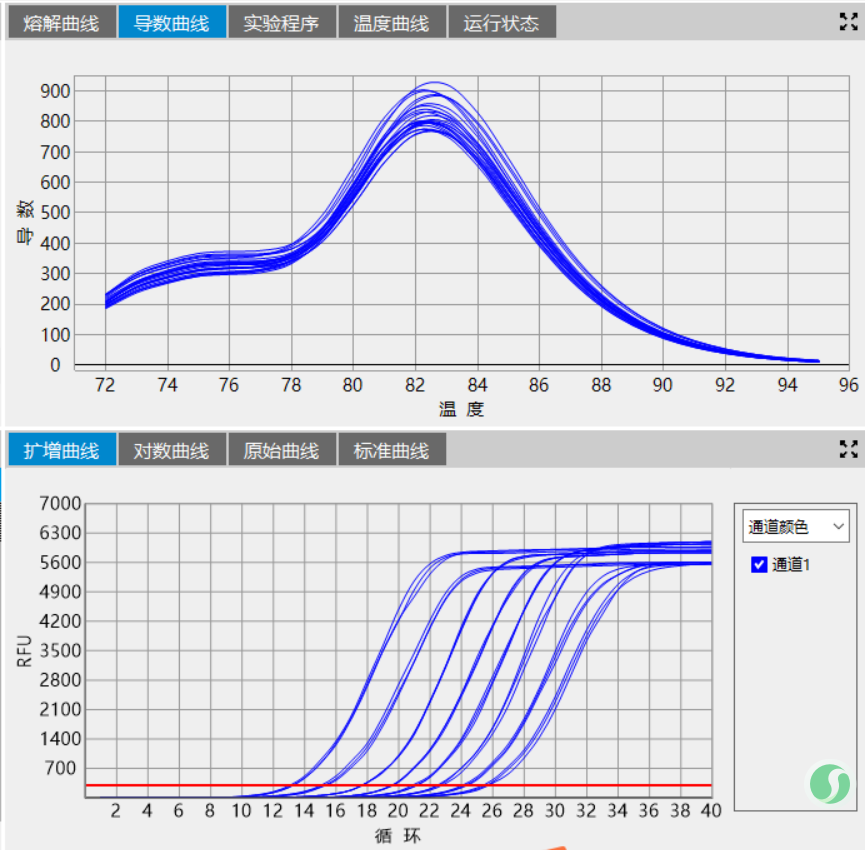 圖1:變溫速率2℃/sec
圖1:變溫速率2℃/sec
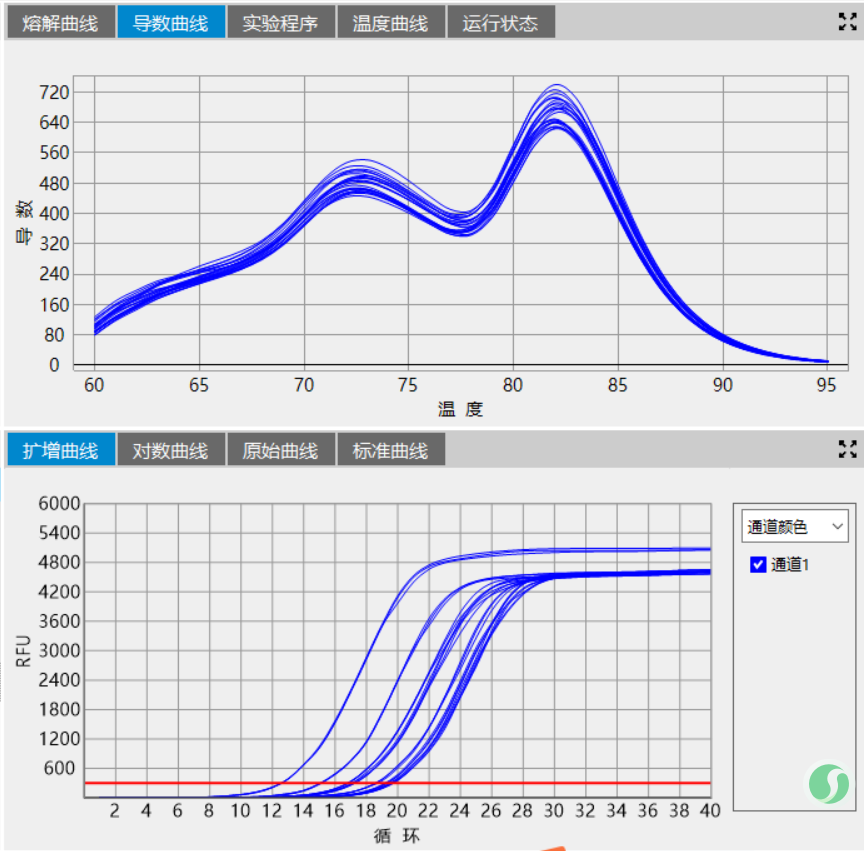 圖2:變溫速率4℃/sec
圖2:變溫速率4℃/sec





