Nature Reviews:新方法學(NAMs)在藥物非臨床安評中的應用
原文聚焦四類藥物(動物無靶點、跨物種靶點差異、非哺乳動物靶點、臨床未預測毒性)的人體體外模型(如器官芯片、類器官)應用案例,強調其在預測人體毒性、補充動物模型局限性方面的價值,并探討風險評估策略及跨行業聯盟對NAMs標準化的推動作用,旨在促進更具人體相關性的安全評估,最終減少藥物開發中的動物使用。
新方法學(NAMs)在候選藥物非臨床安全性評估中的應用正推動監管指南修訂,減少動物實驗依賴。

一、傳統動物模型的局限性與 NAMs 的興起
- 動物模型的不足:
- 物種差異(如 ADME 參數、基因表達)導致臨床前動物研究無法預測人體毒性,例如動物未檢測到的肝毒性在人體試驗中出現。新型療法(如細胞治療、雙特異性抗體)因靶點人特異性,動物模型無效(如嚙齒類不表達 CEA 抗原)。
- NAMs 的技術突破
- 微生理系統(MPS):如肝芯片、心臟芯片,模擬人體器官微環境,用于評估藥物毒性。
- 類器官與 3D 培養:腸類器官聯合免疫細胞,預測 T 細胞療法的腸道毒性。
- 硅基智能工具:如 DILIsym 模型模擬肝毒性機制,BLAST 分析評估靶點同源性。
二、四類藥物的體外評估策略與案例
三、案例研究:通過具體的案例研究(如IMCgp100、MEDI-565等藥物),展示了如何應用NAMs來評估藥物安全性,并在某些情況下減少或避免動物實驗。
3.1 IMCgp100
IMCgp100(tebentafusp)是一種融合蛋白,由可溶性、親和力增強的T細胞受體(TCR)和抗CD3單鏈抗體(scFv)組成,旨在將表達gp100表位的腫瘤細胞和表達CD3的T細胞結合在一起,用于治療表達gp100的腫瘤。其藥物目標在動物物種中缺乏表達或同源性不足,因此沒有相關的動物模型可以用于評估靶向依賴(在靶)毒性。
- 非臨床安全性評估方法:Harper等人開發了一套基于商業可用的2D人類癌細胞系的體外評估。用于評估療效的實驗使用抗原特異性、與適應癥相關的腫瘤細胞,通過測量乳酸脫氫酶(LDH)釋放和凋亡來評估靶細胞殺傷情況。基于干擾素-γ(IFNγ)釋放和體外腫瘤細胞殺傷的數據,有助于計算最小預期生物學效應水平(MABEL)。安全性評估中,識別了表達抗原的人類源性黑素細胞作為靶細胞,并使用單一供體的PBMC作為效應細胞,來研究在靶/非腫瘤活性。通過人類全血的細胞因子釋放實驗(CRA)和血小板激活實驗來評估非靶向或非腫瘤效應,以及評估廣義人類細胞的風險。
- 研究結果與意義:通過該體外評估預測了IMCgp100的MABEL,并確定了首次人體試驗的安全起始劑量,最終該療法成功進入臨床開發。
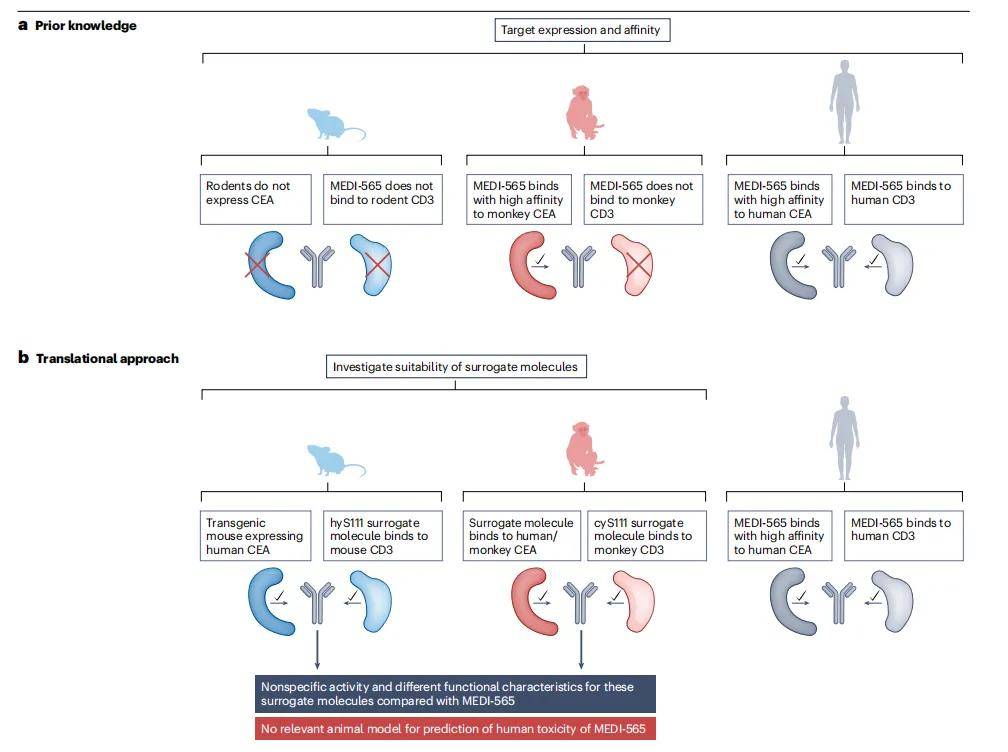
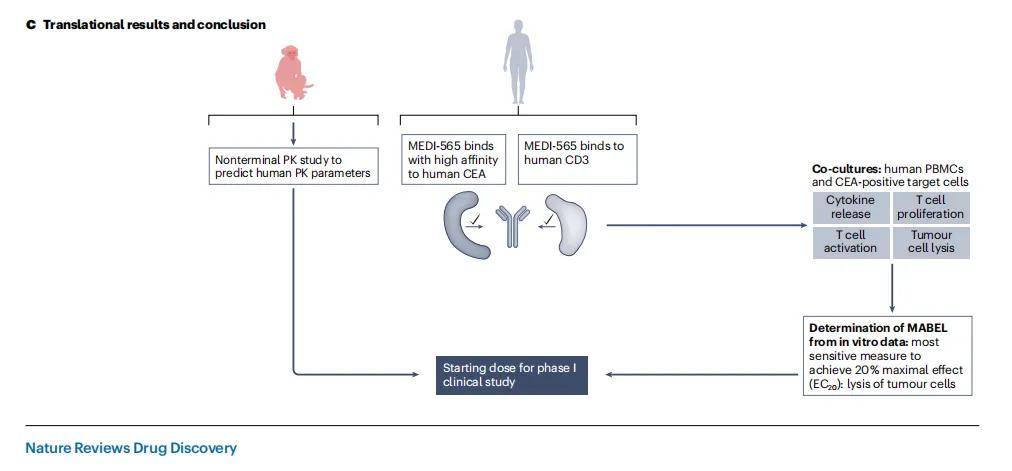
3.2 MEDI-565
MEDI-565是一種新型雙特異性T細胞接合抗體(BiTE),旨在將表達癌胚抗原(CEA)的癌細胞與表達CD3的T細胞結合。由于MEDI-565與人類和食蟹猴CEA結合,但不與食蟹猴CD3結合,且嚙齒動物不表達CEA,因此沒有相關的動物模型可以用于評估其毒性。
- 非臨床安全性評估方法:MEDI-565的非臨床安全性評估方案中使用了在食蟹猴和人類CEA轉基因小鼠中使用的替代雙特異性抗體,但這些替代分子與MEDI-565的特性不同,最終決定不進行任何體內毒理學研究,而是采用僅體外方法,并確定MABEL。通過在共培養中使用人類PBMC和CEA陽性人類腫瘤靶細胞,結合多個人類供體的終點,包括細胞因子釋放、腫瘤細胞裂解、T細胞激活和增殖來確定MABEL。
- 研究結果與意義:體外研究結果表明,MEDI-565能夠誘導T細胞增殖,證明了細胞因子釋放需要同時結合T細胞上的CD3和靶細胞上的CEA,并展示了腫瘤細胞裂解是最敏感的衡量指標,從而確定了MABEL。結合從食蟹猴中獲得的非終末藥代動力學數據,計算出MEDI-565的安全起始劑量,為后續的I期臨床研究奠定了基礎。
3.3 EpCAM靶向TCBs和CEA靶向TCBs
該研究討論了T細胞接合雙特異性抗體(TCBs)在固體瘤治療中的應用,這些抗體可引起I期試驗中的腹瀉,表明存在非腫瘤腸道反應。
- 非臨床安全性評估方法:在非臨床開發中,動物模型未能預測EpCAM靶向或CEA靶向TCBs以及CEA靶向嵌合抗原受體(CAR)T細胞的腸道風險。這可能是由于不同物種間的免疫學差異和靶點組織相關表達的差異。研究人員探討了患者源性腸類器官是否可以用于模擬EpCAM靶向TCBs的臨床毒性,并對正在開發的CEA靶向TCBs的毒性進行建模。
- 研究結果與意義:該模型顯示,所有EpCAM靶向分子觸發了腸類器官中時間-和濃度-依賴性的誘導凋亡。這些結果與臨床報告一致,表明EpCAM靶向雙特異性抗體比結合CEA的抗體更頻繁、更嚴重地引起腸道不良事件。這表明人類類器官可以提供一個穩健和敏感的系統來模擬健康器官中的TCB介導的毒性,優于未能預測這些腸道風險的動物模型。
四、關鍵問題與答案
4.1. 為何新型療法需要NAMs?
答案:新型療法如雙特異性抗體、基因治療等,其靶點具有顯著的人類特異性。以雙特異性抗體為例,像MEDI-565這種CEA/CD3雙抗,在猴體內由于不結合猴CD3,使得傳統基于猴等動物模型的研究無法對其靶向毒性進行有效評估。從分子機制層面來看,動物(如嚙齒類、非人類靈長類)的基因序列及蛋白表達與人類存在差異,導致許多人類特異性靶點在動物體內缺乏表達,或者即便有表達,其功能也與人類靶點大相徑庭。這就使得傳統動物模型難以模擬新型療法在人體中的真實作用情況。
在實際研發過程中,以IMCgp100這種TCR融合蛋白藥物開發為例,由于缺乏相關動物模型,研發團隊采用了純體外評估方案。通過將人腫瘤細胞與人免疫細胞進行共培養,模擬人體免疫系統對腫瘤細胞的攻擊過程,同時開展細胞因子釋放試驗,監測免疫反應過程中細胞因子的釋放情況。基于這些體外試驗數據,成功確定了最小生物學效應劑量(MABEL),為后續的臨床開發提供了關鍵的劑量參考依據,有力地推動了該藥物從實驗室走向臨床應用的進程。
Kirkstall Quasi Vivo類器官串聯器官芯片共培養系統,通過動態培養與多器官互作模擬,正在重塑疾病研究、藥物開發與再生醫學的范式。未來,隨著技術迭代與跨領域合作深化,這一平臺有望成為精準醫學從實驗室到臨床的橋梁,推動人類健康事業的跨越式發展。
4.2. NAMs如何提升肝毒性預測?
答案:傳統動物模型在預測人類肝毒性方面存在較大局限性。從膽汁酸代謝角度分析,人類膽汁酸組成以富含疏水膽汁酸為主,而大鼠、猴等動物的膽汁酸則以極性膽汁酸居多。這種膽汁酸組成的差異,使得動物模型難以準確模擬人類肝臟對藥物的代謝及毒性反應過程。
NAMs中的3D肝類器官和肝芯片技術在提升肝毒性預測準確性方面具有顯著優勢。3D肝類器官通過模擬人體肝臟的三維組織結構,能夠在體外重現肝臟細胞的功能及細胞間相互作用。在肝芯片中,構建了包含多種肝臟細胞類型(如肝細胞、肝星狀細胞、內皮細胞等)的微流控芯片系統,模擬肝臟的微環境,包括血流、營養物質運輸及代謝產物排泄等過程。通過這些技術,可以實時監測藥物在類器官或芯片中的代謝過程及對肝臟細胞的毒性影響。
結合DILIsym計算模型,能夠進一步深入解析藥物導致肝毒性的機制。例如在BAY 1128688的研究中,動物試驗未顯示出肝毒性,但利用肝芯片進行研究時,發現該藥物能夠抑制BSEP(一種膽汁酸鹽輸出泵)的功能。BSEP功能受抑制后,膽汁酸無法正常排出肝細胞,導致膽汁酸在肝細胞內淤積,進而引發肝細胞損傷,這與臨床中觀察到的肝損傷癥狀高度一致。這種多技術聯合的方式,從細胞、組織及系統層面全面解析藥物肝毒性機制,大大提升了肝毒性預測的準確性和可靠性。
4.3. 監管層面如何推動NAMs應用?
答案:監管機構通過一系列立法與指南大力支持NAMs的應用與發展。
- FDA現代化法案2.0/3.0:該法案具有重要的里程碑意義,明確允許在藥物研發過程中使用細胞類器官模型、計算工具等替代動物試驗。以IMCgp100的研發為例,FDA批準了其采用純體外安全評估方案,這一舉措為新型療法的研發開辟了新路徑。法案的實施激勵了藥企積極探索和應用NAMs技術,因為使用這些新技術不僅能夠滿足監管要求,還能在一定程度上縮短藥物研發周期、降低研發成本,同時提升藥物安全性評估的準確性。
- EMA指南:EMA指南明確規定,當動物模型無法有效評估藥物安全性時,必須采用人體體外模型進行補充評估。例如在轉基因動物替代試驗中,要求企業充分考慮使用人類細胞模型、類器官等NAMs技術。此外,EMA還鼓勵藥企在藥物研發早期階段就與監管機構進行溝通,詳細闡述所采用的NAMs方案,以便監管機構能夠及時給予指導和建議,確保研發過程符合法規要求,促進NAMs技術在藥物研發中的合理應用。
- OECD標準:OECD發布的皮膚致敏性評估的“定義方法”(DA),為藥物領域中NAMs的標準化應用提供了重要參考。該標準詳細規定了相關測試的流程、方法及評估指標,使得不同實驗室、不同研究團隊在開展相關研究時能夠遵循統一的規范,提高了研究結果的可比性和可靠性。這對于推動NAMs在藥物安全性評估等領域的廣泛應用具有積極的促進作用,有助于建立全球范圍內對NAMs技術的信任和認可。
北京基爾比生物科技公司主營產品:
Kilby 3D-clinostat 旋轉細胞培養儀,Kilby Gravite微/超重力三維細胞培養系統,
3D回轉重力環境模擬系統,隨機定位儀,
類器官芯片搖擺灌注儀,
Kirkstall 類器官串聯芯片灌流仿生構建系統





