常染色體隱性視網膜色素變性(arRP)相關小鼠模型Rho KO小鼠的介紹
視網膜色素變性(RP)是一組遺傳性視網膜退行性疾病,全球受影響人數超過150萬。其主要病理特征為光感受器細胞進行性凋亡,導致夜盲、視野縮窄,最終可能致盲 [1]。在眾多致病基因中,RHO基因突變是最常見的原因之一,尤其在常染色體顯性RP(adRP)中發揮關鍵作用,這也是目前大多數RHO相關研究、小鼠模型開發及療法探索的重點方向。而在少數情況下,RHO基因的純合功能缺失突變也可導致常染色體隱性RP(arRP),但針對此類arRP的機制研究和模型開發相對不足 [2]。為填補此空白,賽業生物開發并推出Rho KO小鼠模型。該模型通過模擬RHO功能缺失,為研究arRP的發病機制及開發干預策略提供了有力工具。
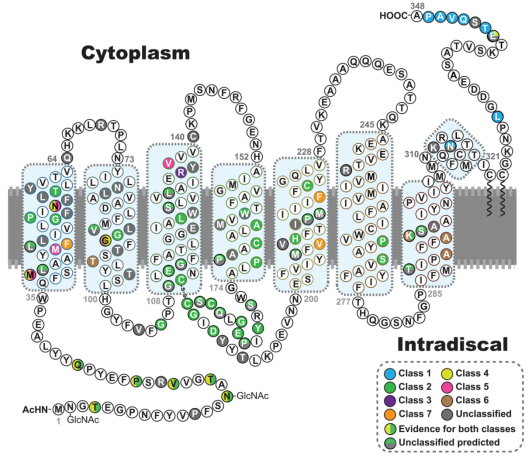
圖1. 與視網膜色素變性(RP)相關的RHO基因突變類型 [2]。
RHO基因與視網膜色素變性(RP)
視網膜色素變性(RP)的全球發病率約為1/4000,其病理特征為視桿細胞和視錐細胞逐漸凋亡 [3]。患者初期通常表現為夜盲,隨后視野逐漸收縮(管狀視野),嚴重者可致完全失明。RHO基因是RP最常見的致病基因之一,其編碼的視紫紅質(Rhodopsin)位于視桿細胞,與11-順式視黃醛結合形成感光色素,并在光照條件下啟動視覺信號轉導級聯反應。作為G蛋白偶聯受體,視紫紅質吸收光子后將光信號轉化為神經信號。這一過程不僅是暗視覺的基礎,對于維持視桿細胞存活和視網膜結構穩定亦至關重要 [4]。
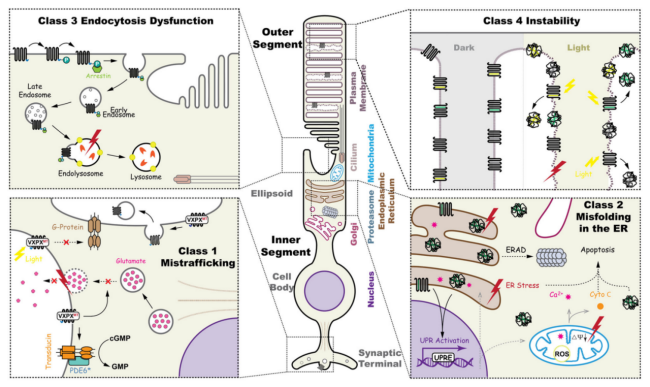
圖2. 視紫紅質(Rhodopsin)蛋白的功能及不同突變類型對其功能的影響 [2]。
RHO基因突變是導致視網膜色素變性(RP)具有遺傳多樣性的重要原因之一。目前已報道超過150種與視網膜疾病相關的RHO突變類型。這些突變主要導致常染色體顯性RP(adRP,約占adRP病例的25%-30%),少數情況下也可引發常染色體隱性RP(arRP)或先天性靜止性夜盲癥(CSNB) [5]。
其致病機制主要包括:
- 功能獲得型(GOF)突變:此類突變導致視紫紅質蛋白錯誤折疊或功能異常,對視桿細胞產生毒性,誘發細胞凋亡,最終引起adRP。例如,P23H突變可導致蛋白錯誤折疊并滯留于內質網(ER),觸發ER應激,進而引起細胞死亡[6]。
- 功能缺失型(LOF)突變:雙等位基因的功能喪失導致無法合成功能性視紫紅質,進而引起視桿細胞外段退化,最終發展為arRP[2, 5-6]。

圖3. 與常染色體顯性RP(adRP)相關的RHO基因突變 [2]。
賽業生物Rho KO小鼠模型
以往關于RHO基因突變的小鼠研究多聚焦于adRP,特別是P23H突變模型,這些模型主要用于模擬顯性遺傳模式下的蛋白毒性機制 [2, 7-8]。然而,為了深入研究由RHO功能完全缺失引起的arRP,并評估旨在恢復或替代視紫紅質功能的療法,功能缺失型動物模型不可或缺。賽業生物全新推出的Rho KO小鼠(產品編號:C001700)通過完全敲除內源性Rho基因,阻斷了視紫紅質的表達,精確模擬了由RHO無效突變(null mutation)引起的病理狀態。這一純合敲除模型忠實再現了人類arRP中視紫紅質缺失的表型,是研究此類隱性遺傳視網膜疾病的重要工具。
其關鍵表型特征包括:
- 視網膜外核層(ONL)變薄
在8周齡時,Rho KO小鼠的視網膜外核層(ONL)厚度明顯下降,表明視桿細胞嚴重喪失,反映出顯著的視網膜退化。
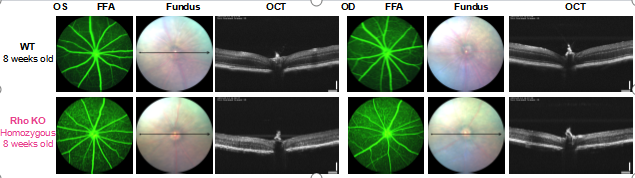
圖4. 8周齡純合Rho KO小鼠和野生型小鼠(WT)眼底形態(Fundus)、光學相干斷層掃描(OCT)和熒光素眼底血管造影(FFA)檢測結果。
- 視網膜電圖(ERG)異常
視網膜電圖(ERG)檢測顯示,該模型小鼠在暗適應和明適應條件下的a波、b波波幅均顯著低于野生型對照,提示感光細胞功能受損,電生理活性下降。
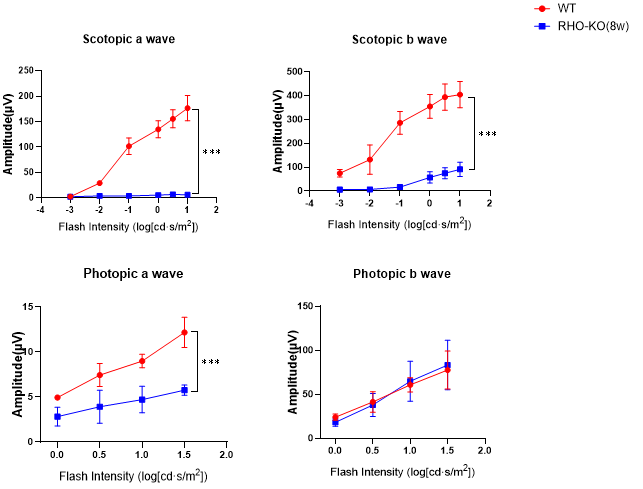
圖5. 8周齡野生型小鼠(WT)和純合Rho KO小鼠眼部ERG檢測結果。
綜上所述,賽業生物的Rho KO小鼠模型(產品編號:C001700)成功模擬了由RHO基因功能完全缺失導致的嚴重視網膜退行性病變。該模型表現為顯著的光感受器細胞丟失(ONL變薄)和視網膜電生理功能嚴重受損(ERG波幅降低)。此模型不僅為研究arRP等隱性遺傳性視網膜疾病的發病機制提供了有力工具,更為評估基因治療、細胞治療等新型干預策略構建了重要的臨床前研究平臺。此外,賽業生物亦提供多種眼科疾病研究模型,包括野生型(WT)及攜帶經典P23H突變人源化RHO基因的adRP小鼠模型等,以滿足針對不同類型視網膜疾病的研究需求。
參考文獻
- Hartong DT, Berson EL, Dryja TP. Retinitis pigmentosa. Lancet. 2006 Nov 18;368(9549):1795-809.
- Athanasiou D, Aguila M, Bellingham J, Li W, McCulley C, Reeves PJ, Cheetham ME. The molecular and cellular basis of rhodopsin retinitis pigmentosa reveals potential strategies for therapy. Prog Retin Eye Res. 2018 Jan;62:1-23.
- Hofmann KP, Lamb TD. Rhodopsin, light-sensor of vision. Prog Retin Eye Res. 2023 Mar;93:101116.
- Meng D, Ragi SD, Tsang SH. Therapy in Rhodopsin-Mediated Autosomal Dominant Retinitis Pigmentosa. Mol Ther. 2020 Oct 7;28(10):2139-2149.
- Hofmann L, Palczewski K. The G protein-coupled receptor rhodopsin: a historical perspective. Methods Mol Biol. 2015;1271:3-18.
- Vingolo EM, Mascolo S, Miccichè F, Manco G. Retinitis Pigmentosa: From Pathomolecular Mechanisms to Therapeutic Strategies. Medicina (Kaunas). 2024 Jan 22;60(1):189.
- Barwick SR, Smith SB. Comparison of Mouse Models of Autosomal Dominant Retinitis Pigmentosa Due to the P23H Mutation of Rhodopsin. Adv Exp Med Biol. 2023;1415:341-345.
- Vasudevan S, Senapati S, Pendergast M, Park PS. Aggregation of rhodopsin mutants in mouse models of autosomal dominant retinitis pigmentosa. Nat Commun. 2024 Feb 16;15(1):1451.





