上皮細(xì)胞的多樣性與功能:從屏障到信號(hào)傳導(dǎo)的多維角色
上皮細(xì)胞是構(gòu)成上皮組織的基本功能單位,廣泛分布于機(jī)體的內(nèi)外表面,如皮膚、消化道、呼吸道、泌尿生殖道以及腺體等。它們不僅是機(jī)體的第一道物理和化學(xué)屏障,還參與物質(zhì)轉(zhuǎn)運(yùn)、分泌、感覺(jué)傳遞以及免疫調(diào)節(jié)等多種生理過(guò)程。近年來(lái),隨著單細(xì)胞測(cè)序技術(shù)、類(lèi)器官模型和基因編輯技術(shù)的快速發(fā)展,科學(xué)家們對(duì)上皮細(xì)胞的異質(zhì)性、功能多樣性及其在疾病中的作用有了更深入的理解。
上皮細(xì)胞的分類(lèi)與結(jié)構(gòu)特征:
上皮組織根據(jù)表層細(xì)胞的形狀以及細(xì)胞層數(shù)的單層或多層進(jìn)行分類(lèi)。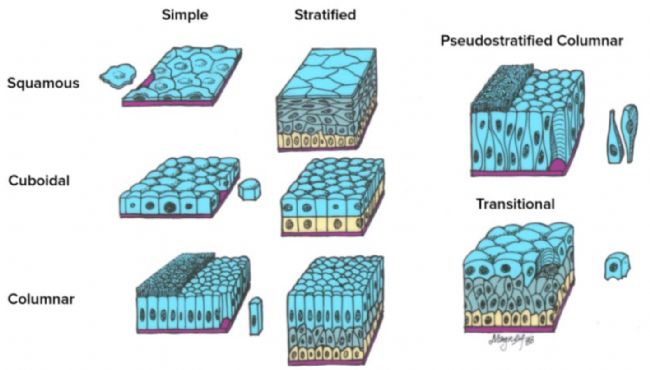
圖1.上皮細(xì)胞
表層細(xì)胞的形狀:
上皮細(xì)胞的功能多樣性
上皮細(xì)胞的功能遠(yuǎn)不止于物理屏障。它們還積極參與細(xì)胞間通訊、免疫調(diào)節(jié)和組織穩(wěn)態(tài)的維持。例如,腸道上皮細(xì)胞能夠分泌多種細(xì)胞因子(如IL-10、TGF-β)和抗菌肽(如防御素),調(diào)節(jié)腸道菌群平衡和局部免疫反應(yīng)。此外,上皮細(xì)胞在組織修復(fù)和再生中發(fā)揮關(guān)鍵作用。當(dāng)組織受損時(shí),位于基底層的上皮干細(xì)胞能夠快速增殖并分化為功能性上皮細(xì)胞,促進(jìn)傷口愈合和組織重建。
在信號(hào)傳導(dǎo)方面,上皮細(xì)胞通過(guò)多種受體和信號(hào)通路感知外界環(huán)境變化并作出響應(yīng)。例如,皮膚上皮細(xì)胞通過(guò)Toll樣受體(TLRs)識(shí)別病原體相關(guān)分子模式(PAMPs),啟動(dòng)先天免疫反應(yīng)。此外,上皮細(xì)胞還通過(guò)分泌外泌體等方式與其他細(xì)胞(如免疫細(xì)胞和間質(zhì)細(xì)胞)進(jìn)行通訊,調(diào)控局部微環(huán)境。
上皮細(xì)胞與疾病的關(guān)系
上皮細(xì)胞的功能異常與多種疾病密切相關(guān)。例如,上皮屏障功能的破壞可能導(dǎo)致炎癥性腸病(IBD)、哮喘和過(guò)敏性疾病;而上皮細(xì)胞的異常增殖、分化和凋亡則是癌癥發(fā)生的重要機(jī)制之一。在腫瘤微環(huán)境中,上皮細(xì)胞與免疫細(xì)胞和間質(zhì)細(xì)胞的相互作用顯著影響腫瘤的進(jìn)展和轉(zhuǎn)移。此外,上皮細(xì)胞在纖維化疾病(如肺纖維化和肝纖維化)中也扮演重要角色,其上皮-間質(zhì)轉(zhuǎn)化(EMT)過(guò)程被認(rèn)為是纖維化發(fā)生的關(guān)鍵環(huán)節(jié)。
研究前沿與展望
近年來(lái),單細(xì)胞測(cè)序技術(shù)的應(yīng)用揭示了上皮細(xì)胞的高度異質(zhì)性,為研究其功能多樣性提供了新的視角。類(lèi)器官模型的建立則使得在體外模擬上皮組織的發(fā)育和疾病成為可能,為藥物篩選和個(gè)性化治療提供了重要工具。未來(lái),結(jié)合多組學(xué)分析和基因編輯技術(shù),研究者們有望進(jìn)一步解析上皮細(xì)胞在生理和病理過(guò)程中的分子機(jī)制,為相關(guān)疾病的精準(zhǔn)治療提供新的靶點(diǎn)。
康和達(dá) Celloger 系列活細(xì)胞成像儀 是一款先進(jìn)的箱內(nèi)細(xì)胞成像設(shè)備,專(zhuān)為實(shí)時(shí)觀察和分析活細(xì)胞動(dòng)態(tài)而設(shè)計(jì)。在上皮細(xì)胞研究中,Celloger 提供了高分辨率、長(zhǎng)時(shí)間的成像能力,能夠捕捉上皮細(xì)胞的形態(tài)變化、細(xì)胞間相互作用以及功能動(dòng)態(tài)。箱內(nèi)成像和低光毒性設(shè)計(jì),確保上皮細(xì)胞在接近生理?xiàng)l件下的長(zhǎng)時(shí)間培養(yǎng)和觀察。
為什么選擇 康和達(dá) Celloger?
參考文獻(xiàn)
上皮細(xì)胞的分類(lèi)與結(jié)構(gòu)特征:
上皮組織根據(jù)表層細(xì)胞的形狀以及細(xì)胞層數(shù)的單層或多層進(jìn)行分類(lèi)。

圖1.上皮細(xì)胞
表層細(xì)胞的形狀:
- 鱗狀上皮(Squamous) - 細(xì)胞扁平,寬度大于高度
- 細(xì)胞核通常比扁平細(xì)胞高,并凸向管腔
- 細(xì)胞質(zhì)較薄,難以觀察
- 立方上皮(Cuboidal ) - 細(xì)胞的高度與寬度相近
- 球形細(xì)胞核位于細(xì)胞中央
- 柱狀上皮(Columnar) - 細(xì)胞的高度大于寬度
- 橢圓形細(xì)胞核位于細(xì)胞基部附近
- 單層上皮(Simple) - 僅由一層細(xì)胞組成
- 所有細(xì)胞均與基底膜(紫色)接觸
- 復(fù)層上皮(Stratified ) - 由兩層或更多層細(xì)胞組成
- 只有最底層的細(xì)胞(黃色)與基底膜(紫色)接觸
- 假?gòu)?fù)層柱狀上皮(Pseudostratified Columnar)
- 單層細(xì)胞
- 細(xì)胞核位于不同水平
- 并非所有細(xì)胞都到達(dá)表面
- 所有細(xì)胞均與基底膜(紫色)接觸
- 變移上皮(Transitional) - 用于上皮組織被拉伸的部位
- 多層細(xì)胞
- 只有最底層的細(xì)胞(黃色)與基底膜(紫色)接觸
- 形態(tài)隨組織的松弛或拉伸而變化
- 松弛狀態(tài) - 表層為大而圓頂狀的細(xì)胞
- 拉伸狀態(tài) - 表層為扁平細(xì)胞
上皮細(xì)胞的功能多樣性
上皮細(xì)胞的功能遠(yuǎn)不止于物理屏障。它們還積極參與細(xì)胞間通訊、免疫調(diào)節(jié)和組織穩(wěn)態(tài)的維持。例如,腸道上皮細(xì)胞能夠分泌多種細(xì)胞因子(如IL-10、TGF-β)和抗菌肽(如防御素),調(diào)節(jié)腸道菌群平衡和局部免疫反應(yīng)。此外,上皮細(xì)胞在組織修復(fù)和再生中發(fā)揮關(guān)鍵作用。當(dāng)組織受損時(shí),位于基底層的上皮干細(xì)胞能夠快速增殖并分化為功能性上皮細(xì)胞,促進(jìn)傷口愈合和組織重建。
在信號(hào)傳導(dǎo)方面,上皮細(xì)胞通過(guò)多種受體和信號(hào)通路感知外界環(huán)境變化并作出響應(yīng)。例如,皮膚上皮細(xì)胞通過(guò)Toll樣受體(TLRs)識(shí)別病原體相關(guān)分子模式(PAMPs),啟動(dòng)先天免疫反應(yīng)。此外,上皮細(xì)胞還通過(guò)分泌外泌體等方式與其他細(xì)胞(如免疫細(xì)胞和間質(zhì)細(xì)胞)進(jìn)行通訊,調(diào)控局部微環(huán)境。
上皮細(xì)胞與疾病的關(guān)系
上皮細(xì)胞的功能異常與多種疾病密切相關(guān)。例如,上皮屏障功能的破壞可能導(dǎo)致炎癥性腸病(IBD)、哮喘和過(guò)敏性疾病;而上皮細(xì)胞的異常增殖、分化和凋亡則是癌癥發(fā)生的重要機(jī)制之一。在腫瘤微環(huán)境中,上皮細(xì)胞與免疫細(xì)胞和間質(zhì)細(xì)胞的相互作用顯著影響腫瘤的進(jìn)展和轉(zhuǎn)移。此外,上皮細(xì)胞在纖維化疾病(如肺纖維化和肝纖維化)中也扮演重要角色,其上皮-間質(zhì)轉(zhuǎn)化(EMT)過(guò)程被認(rèn)為是纖維化發(fā)生的關(guān)鍵環(huán)節(jié)。
研究前沿與展望
近年來(lái),單細(xì)胞測(cè)序技術(shù)的應(yīng)用揭示了上皮細(xì)胞的高度異質(zhì)性,為研究其功能多樣性提供了新的視角。類(lèi)器官模型的建立則使得在體外模擬上皮組織的發(fā)育和疾病成為可能,為藥物篩選和個(gè)性化治療提供了重要工具。未來(lái),結(jié)合多組學(xué)分析和基因編輯技術(shù),研究者們有望進(jìn)一步解析上皮細(xì)胞在生理和病理過(guò)程中的分子機(jī)制,為相關(guān)疾病的精準(zhǔn)治療提供新的靶點(diǎn)。
康和達(dá) Celloger 系列活細(xì)胞成像儀 是一款先進(jìn)的箱內(nèi)細(xì)胞成像設(shè)備,專(zhuān)為實(shí)時(shí)觀察和分析活細(xì)胞動(dòng)態(tài)而設(shè)計(jì)。在上皮細(xì)胞研究中,Celloger 提供了高分辨率、長(zhǎng)時(shí)間的成像能力,能夠捕捉上皮細(xì)胞的形態(tài)變化、細(xì)胞間相互作用以及功能動(dòng)態(tài)。箱內(nèi)成像和低光毒性設(shè)計(jì),確保上皮細(xì)胞在接近生理?xiàng)l件下的長(zhǎng)時(shí)間培養(yǎng)和觀察。
為什么選擇 康和達(dá) Celloger?
- 高分辨率實(shí)時(shí)成像:捕捉上皮細(xì)胞的細(xì)微變化,從細(xì)胞遷移到屏障功能形成,盡在掌握。
- 長(zhǎng)時(shí)間無(wú)標(biāo)記觀察:低光毒性設(shè)計(jì),確保細(xì)胞在生理狀態(tài)下長(zhǎng)時(shí)間存活,真實(shí)反映細(xì)胞行為。
- 箱內(nèi)成像:箱內(nèi)培養(yǎng)穩(wěn)定環(huán)境,為上皮細(xì)胞提供最接近生理的培養(yǎng)條件。
- 自動(dòng)化分析與高效操作:具備強(qiáng)大的數(shù)據(jù)存儲(chǔ)和圖像分析功能。通過(guò)電腦實(shí)時(shí)訪問(wèn)實(shí)驗(yàn)數(shù)據(jù)和查看細(xì)胞培養(yǎng)情況,優(yōu)化日常細(xì)胞培養(yǎng)工作并將成像結(jié)果標(biāo)準(zhǔn)化,改善下游實(shí)驗(yàn)流程。
- 上皮細(xì)胞屏障功能研究:實(shí)時(shí)監(jiān)測(cè)緊密連接形成與破壞,評(píng)估藥物或病原體對(duì)屏障功能的影響。
- 細(xì)胞遷移與增殖分析:追蹤上皮細(xì)胞的遷移路徑和增殖動(dòng)態(tài),研究傷口愈合或癌癥轉(zhuǎn)移機(jī)制。
- 藥物篩選與毒性測(cè)試:快速評(píng)估藥物對(duì)上皮細(xì)胞的作用,加速藥物開(kāi)發(fā)進(jìn)程。
- 疾病模型構(gòu)建:利用類(lèi)器官或3D培養(yǎng)技術(shù),模擬復(fù)雜上皮組織結(jié)構(gòu),研究疾病機(jī)制。

參考文獻(xiàn)
- Peterson, L. W., & Artis, D. (2014). Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology, 14(3), 141-153.
- Clevers, H. (2016). Modeling development and disease with organoids. Cell, 165(7), 1586-1597.
- Kalluri, R., & Weinberg, R. A. (2009). The basics of epithelial-mesenchymal transition. Journal of Clinical Investigation, 119(6), 1420-1428.
- Tang, P. C., et al. (2021). Single-cell transcriptomics reveals the role of epithelial cell heterogeneity in tissue homeostasis and disease. Nature Communications, 12(1), 1-15.
標(biāo)簽:
上皮細(xì)胞
活細(xì)胞成像儀
- 上皮細(xì)胞的多樣性與功能:從屏障到信號(hào)傳導(dǎo)的多維角色
- 常見(jiàn)細(xì)胞計(jì)數(shù)方法的原理及應(yīng)用場(chǎng)景
- 電穿孔技術(shù)的原理及其在細(xì)胞轉(zhuǎn)染中的應(yīng)用
- 淺析連續(xù)生產(chǎn)工藝(CM)與過(guò)程分析技術(shù)(PAT)
- 精準(zhǔn)洞察細(xì)胞遷移:活細(xì)胞成像儀為劃痕實(shí)驗(yàn) “撥云見(jiàn)日”
- 活細(xì)胞成像技術(shù):照亮類(lèi)器官研究的“黑匣子”
- 活細(xì)胞動(dòng)態(tài)成像及分析系統(tǒng)在細(xì)胞毒性研究中的應(yīng)用
- 細(xì)胞體外動(dòng)態(tài)培養(yǎng)系統(tǒng)在藥物研發(fā)與細(xì)胞動(dòng)力學(xué)中的應(yīng)用
- 澤匯生物成為安捷倫北京區(qū)細(xì)胞分析線產(chǎn)品核心代理商
- NGDx第十屆先進(jìn)診斷技術(shù)開(kāi)發(fā)論壇首批嘉賓重磅揭曉
- 第二屆RNA World 2025國(guó)際論壇通知
- 安捷倫推出XF Flex分析儀:3D組織與類(lèi)器官研究新紀(jì)元
- NGDx2025第十屆先進(jìn)診斷技術(shù)開(kāi)發(fā)與應(yīng)用論壇通知
- 森西賽智亮相中國(guó)衰老科學(xué)大會(huì)暨國(guó)際衰老生物學(xué)大會(huì)
- 2025 第十八屆細(xì)胞產(chǎn)業(yè)大會(huì)(深圳)通知
- 安捷倫xCELLigence實(shí)時(shí)細(xì)胞分析助力Autolus獲批
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





