去唾液酸糖蛋白受體(ASGPR)的表達機制與作用
概述
去唾液酸糖蛋白受體(ASGPR),又稱“Ashwell–Morell”受體,是最早從哺乳動物凝集素中發現的一種受體。ASGPR能夠特異性高效識別以非還原半乳糖或N-乙酰半乳糖胺為末端的糖蛋白或分子。此外,ASGPR還參與細胞纖連蛋白、親血栓成分、肝脂蛋白和血清免疫球蛋白-A的攝取。ASGPR與病原體細胞成分的結合也被認為是肝臟感染性疾病的重要原因之一。
ASGPR的表達
ASGPR主要在肝細胞中表達,但在其他細胞類型中也有檢測到,包括腹腔巨噬細胞、大鼠和人類的睪丸、人類精子、腸道上皮細胞以及外周血單核細胞等。有研究表明,大腸癌的肝轉移病灶中也存在ASGPR的表達。盡管如此,肝細胞中的ASGPR表達量遠高于其他組織。
ASGPR的表達可能受到多種因素的影響。例如,乙醇、四氯化碳、脂多糖和抗Fas抗體會損害肝臟中ASGPR的表達。此外,糖尿病狀態和部分肝切除也可能導致ASGPR功能障礙。
ASGPR與配體的結合
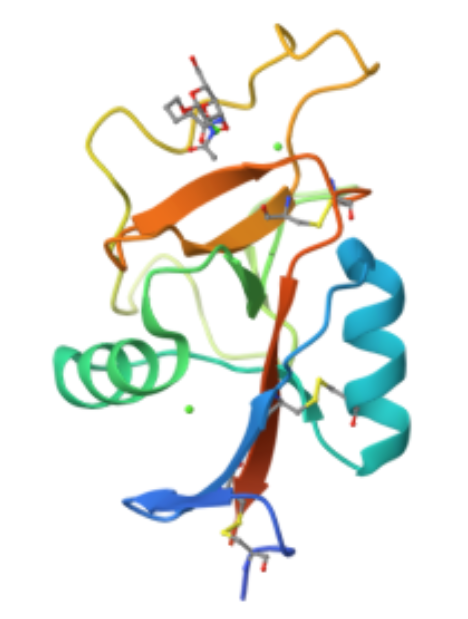
人類ASGPR由46 kDa和50 kDa兩種多肽亞基組成。每個亞基均為II型跨膜蛋白,其糖識別域(CRD)被認為是ASGPR與非還原半乳糖殘基和N-乙酰半乳糖胺結合的關鍵區域。鈣離子在ASGPR與配體的結合中起重要作用,ASGPR的CRD含有三個鈣離子結合位點,但其結合親和力較低。受體鈣離子與配體氧原子之間的配位鍵距離為2.8-3.0埃。
ASGPR對半乳糖(Gal)和N-乙酰半乳糖胺(GalNAc)具有高親和力。其H1型亞基的活性結合位點包括天冬氨酸241、天冬氨酸265、天冬酰胺264、谷氨酸252、谷氨酰胺239和色氨酸243等氨基酸殘基。這些位點通過酰胺鍵和羧基側鏈與半乳糖的3位和4位羥基形成氫鍵。天然配體(如阿拉伯半乳聚糖和普魯蘭多糖)由于含有多個糖二聚體,能夠形成更多的氫鍵,從而增強與ASGPR的結合。此外,ASGPR亞基的三維結構預測顯示,寡聚糖可能通過三觸角結合模式與受體結合。
ASGPR的內化
ASGPR通過與配體結合,在肝細胞質膜表面形成網格蛋白包被的囊泡,并通過網格蛋白介導的內吞作用內化。Gal/GalNAc與ASGPR的結合依賴于pH 6的環境和鈣離子的存在。配體與ASGPR結合后,觸發網格蛋白包被的小窩形成,隨后ASGPR迅速內化,其內化速率常數為3.4×10⁸,半衰期約為3分鐘。
內化過程中,Dynamin蛋白通過水解GTP驅動網格蛋白包被的囊泡(直徑約100-120 nm)從質膜上脫離。囊泡脫去網格蛋白包被后,ASGPR可被重復利用。多個內體融合形成管狀腔室和囊泡,其pH值約為6。隨后,這些內體被分選至回收內體或早期溶酶體小泡中。溶酶體酶從高爾基體轉運至成熟溶酶體,其pH值降至5.4,削弱了鈣離子與ASGPR的結合力,導致配體從ASGPR-配體復合物中釋放。去唾液酸糖蛋白配體在溶酶體中被降解,而ASGPR則免受破壞。
內吞過程受多種理化常數的影響,如解離常數和配體密度等。循環內體能夠保護質膜表面的ASGPR,使其半衰期在質膜上可達約20小時。
產品信息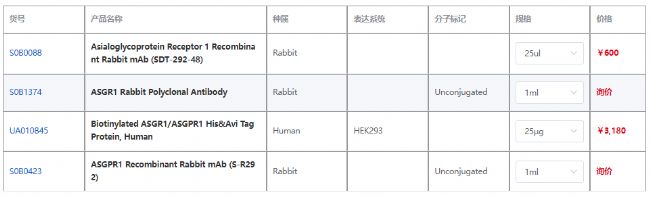
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。





