InnoScan文獻(xiàn)解讀:基于抗體微陣列的細(xì)胞外囊泡蛋白多重分析技術(shù)

技術(shù)原理與工作流程
EVPio技術(shù)的核心分為三個(gè)步驟:
1. 抗體微陣列捕獲EVs:通過噴墨打印技術(shù)在醛基化玻片上制備16個(gè)抗體微陣列,每個(gè)陣列包含10×10的抗體斑點(diǎn)(圖1A,1B),靶向EVs表面蛋白(如EpCAM、CD9等)。
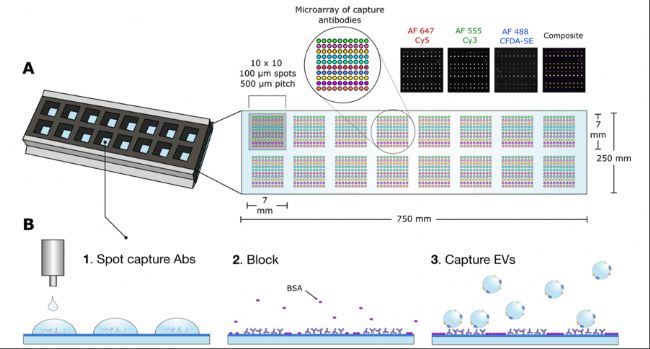
圖1:A, B
2. 抗原修復(fù)(AR)與透化處理:優(yōu)化后的AR條件(90°C PBS處理1分鐘)打破了EVs內(nèi)部蛋白的交叉連接,使其能被抗體識(shí)別(圖2A)。實(shí)驗(yàn)數(shù)據(jù)顯示,AR處理后HSP90(內(nèi)蛋白)信號(hào)提升至51,000 RFU,而EGFR(外蛋白)信號(hào)保持相對(duì)穩(wěn)定。
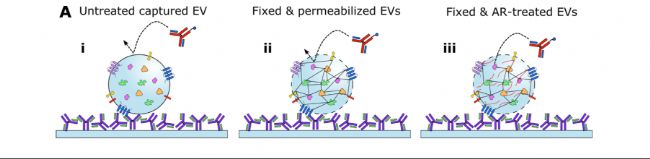
圖2: A
3. 多重檢測(cè)與信號(hào)放大:采用寡核苷酸條形碼標(biāo)記的檢測(cè)抗體和分支DNA擴(kuò)增技術(shù)(圖3,A,B, C)。其中,雙分支DNA樹(4個(gè)熒光基團(tuán))的信噪比(SNR)與傳統(tǒng)的生物素-鏈霉親和素法相當(dāng)(圖3D)。
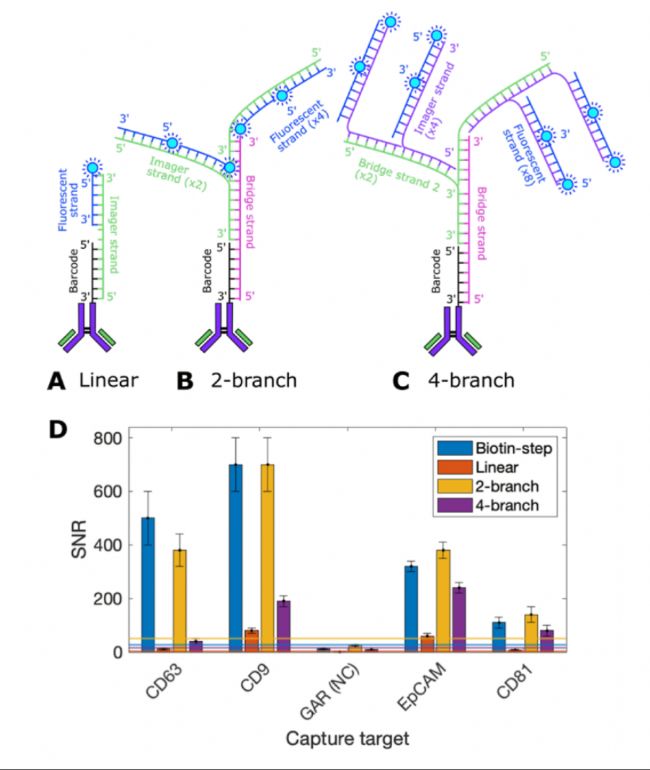
圖3.
InnoScan的作用:該掃描儀用于熒光信號(hào)的定量采集,通過多通道成像(如Alexa Fluor 488、Cy5等)解析不同蛋白的表達(dá)水平。HT29 EVs通過InnoScan三色熒光信號(hào)(Alexa Fluor 647、Cy3、Alexa Fluor 488nn)同步檢測(cè)HSP70、CD9和CD63。
關(guān)鍵數(shù)據(jù)與發(fā)現(xiàn)
研究以結(jié)直腸癌細(xì)胞(HT29和SW403)的EVs為模型,通過四種表面蛋白(EpCAM、CD9、CD63、CD81)捕獲EVs, 并檢測(cè)12種內(nèi)外蛋白的共表達(dá)模式(圖5)。
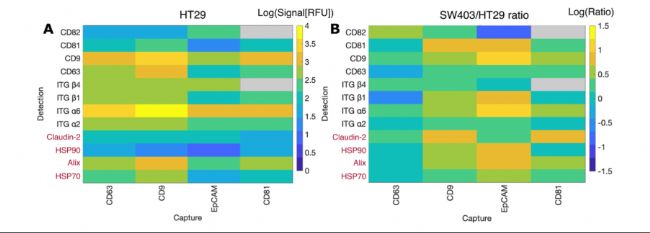
圖5. 對(duì)四種捕獲抗體和陰性對(duì)照(GFP)所結(jié)合的HT29與SW403細(xì)胞外囊泡(濃度1.8×10¹⁰顆粒/毫升)進(jìn)行多重EVPio分析,通過四個(gè)獨(dú)立的三重檢測(cè)同時(shí)分析12種內(nèi)外蛋白。(A)HT29與(B)SW403囊泡的表型分型結(jié)果。SW403的數(shù)據(jù)以SW403與HT29信號(hào)比值呈現(xiàn),突出兩細(xì)胞系囊泡差異。內(nèi)部蛋白標(biāo)為紅色強(qiáng)調(diào)。HT29囊泡中CD9⁺亞群總體信號(hào)最強(qiáng),其中ITG α6、CD63、ITG β1和ITG β4為顯著檢出標(biāo)志物,HSP70與Alix是最強(qiáng)內(nèi)部靶點(diǎn)。SW403囊泡的EpCAM⁺亞群中ITG α6、CD9和CD81信號(hào)顯著更高。灰色數(shù)值表示未檢測(cè)到信號(hào)。
技術(shù)優(yōu)勢(shì)與局限性
EVPio 技術(shù)優(yōu)勢(shì):
1.高通量:?jiǎn)螐埐F煞治?6個(gè)樣本,12個(gè)指標(biāo)檢測(cè)。
2.靈敏度:分支DNA擴(kuò)增提升了低豐度內(nèi)蛋白的檢出限。
3.靈活性:寡核苷酸條形碼避免了抗體物種限制。 局限性:AR處理會(huì)降低外蛋白信號(hào),需通進(jìn)一步實(shí)驗(yàn)優(yōu)化。此外,Cy3通道易受背景干擾,建議改用近紅外熒光基團(tuán)。
總結(jié)與展望
EVPio技術(shù)通過整合抗體微陣列、InnoScan掃描儀和分支DNA擴(kuò)增,為EVs蛋白組學(xué)研究提供了新工具。未來可應(yīng)用于臨床樣本分析,例如通過EVs蛋白特征鑒定癌癥亞型。研究者計(jì)劃進(jìn)一步優(yōu)化抗原修復(fù)條件,并探索與測(cè)序技術(shù)的聯(lián)用,以提升多重檢測(cè)能力。
文獻(xiàn)原文鏈接:https://doi.org/10.1021/acssensors.2c01750
- 沃特世推出新型快速篩選差示掃描量熱儀(RS-DSC)
- 上海亞晶生物科技有限公司誠(chéng)聘技術(shù)支持和銷售經(jīng)理
- Applied BioCode公司誠(chéng)邀數(shù)碼液相芯片產(chǎn)品國(guó)內(nèi)代理商
- 伯豪將舉辦2017年度Agilent 2100/4200用戶交流會(huì)
- 安捷倫微陣列芯片掃描儀獲中國(guó)批準(zhǔn) 應(yīng)用于體外診斷
- 法國(guó)Innopsys芯片掃描儀入駐中國(guó)市場(chǎng)!
- 安捷倫與DGIST就神經(jīng)代謝組學(xué)研究達(dá)成合作
- 上海仁科生物成為Galileo組織芯片儀全國(guó)總代理
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





