白介素-12(IL-12)的分子結構、作用及調節機制
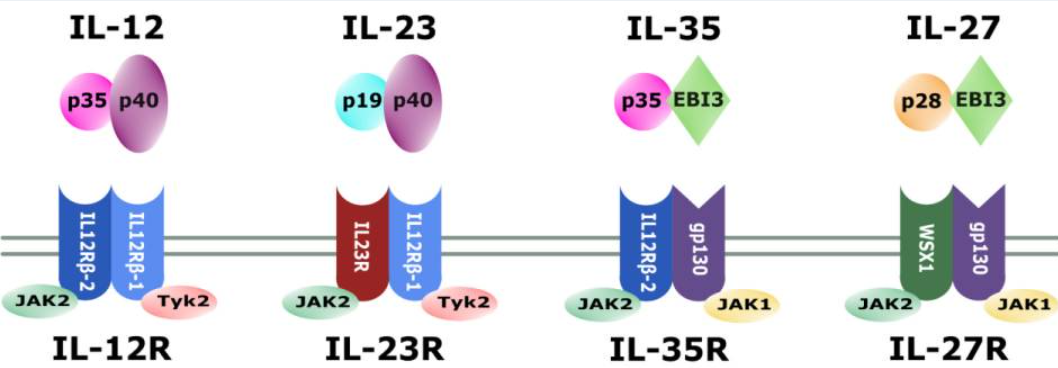
IL-12是一種異源二聚體細胞因子,由α鏈p35(約35 kDa)和β鏈p40(約40 kDa)組成。這兩個亞基分別由不同基因編碼(人類基因位于第3號和5號染色體)。值得注意的是,p35本身不具備獨立分泌的能力,必須與p40結合后才能正確折疊并分泌為生物活性的IL-12異質二聚體(通常稱為IL-12p70)。IL-12家族其它成員也采用類似結構:例如IL-12p40與另一α鏈IL-23p19可組成IL-23,而p35也可與EBI3(EB病毒誘導基因3)結合形成免疫抑制性細胞因子IL-35。這種共享亞基機制使得IL-12與IL-23等細胞因子在結構上具有親緣關系。
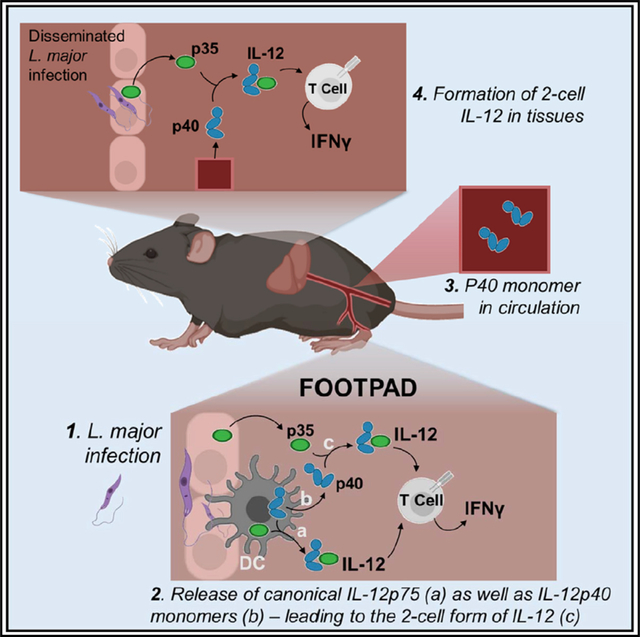
IL-12p40亞基在血清和細胞培養上清中常以過量單體形式出現,并能形成p40-p40同二聚體。研究表明,p40同二聚體可拮抗IL-12p70促進IFN-γ產生的活性,盡管其生理意義尚未完全明了。p40單體過量分泌可能參與調節免疫平衡,而p35的表達則更加廣泛,但僅在與p40結合后才能發揮作用。
IL-12受體的組成與表達分布
IL-12的細胞表面受體由兩個跨膜亞基構成:IL-12Rβ1和IL-12Rβ2。其中IL-12Rβ1與IL-23受體共用(IL-23信號復合體由IL-12Rβ1和專屬的IL-23R構成),而IL-12Rβ2則特異性地與IL-12結合形成高親和力受體。IL-12Rβ1與IL-12Rβ2同屬于gp130家族,其胞外結構域與gp130蛋白具有同源性。在免疫細胞中,兩種亞基主要表達在活化的T淋巴細胞和NK細胞表面。活化狀態下的B細胞也可表達IL-12受體:在IFN-γ和IL-12共同作用下,人B細胞上調IL-12Rβ2表達,并在IL-12刺激下發生STAT4磷酸化,表明B細胞在特定條件下也能響應IL-12信號。值得一提的是,IL-12Rβ1的親和力較低(Kd ~2–6 nM),每細胞表達數量較多(約1000–5000個受體),而IL-12Rβ2則為高親和力受體(Kd ~5–20 pM),表達數量相對較少(約100–1000個)。
在IL-12信號傳導中,IL-12Rβ1和IL-12Rβ2的胞內區分別結合不同的Janus激酶:IL-12Rβ1主要結合Tyk2,而IL-12Rβ2結合JAK2。IL-12與受體結合后,受體相關的JAK2和TYK2被活化并發生自磷酸化,進而磷酸化受體胞內區上的酪氨酸。IL-12Rβ2上關鍵的磷酸化位點(如Y800)為STAT4提供結合位點,形成信號平臺。此外,STAT4可被激酶家族中的p38 MAPK磷酸化(絲氨酸位點),這一修飾對STAT4的轉錄活性和IFN-γ產生至關重要。此外,IL-12還可激活PI3K/Akt通路,促進T細胞增殖。
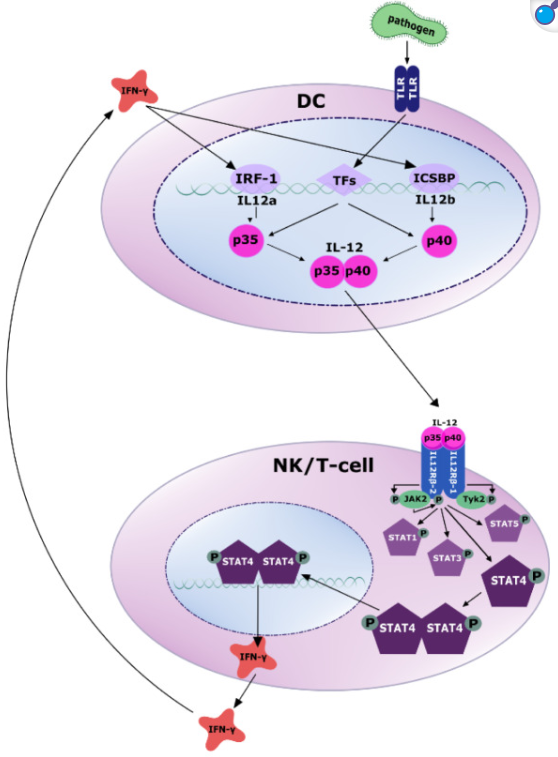
抗原呈遞細胞 (APC),例如樹突狀細胞,通過 Toll 樣受體(TLR) 感知 PAMP(病原體相關分子模式)。隨后,多種轉錄因子被激活,誘導 IL-12p35 和 IL-12p40 的轉錄(更多詳情請參閱原文)。分泌的 IL-12 異二聚體與 NK 細胞和 T 細胞上的受體結合,募集酪氨酸激酶 JAK2 和 TYK2,并通過酪氨酸磷酸化激活 JAK2。活化的 JAK2 磷酸化 IL12Rβ2 亞基,進而通過磷酸化激活 STAT4。隨后,磷酸化的 STAT4 發生同二聚化或異二聚化,轉位至細胞核,并通過結合靶 DNA 調控基因轉錄。主要靶基因是 IFN-γ,其反過來通過 IRF-1 和 ICSBP 誘導 IL-12 產生的轉錄激活。
IL-12信號的負反饋調控為防止過度的炎癥反應,IL-12信號通路受到多種負反饋機制的制約。抑制性細胞因子信號分子SOCS-3是IL-12負調節的關鍵分子之一。SOCS-3的SH2結構域能夠識別并結合磷酸化的IL-12Rβ2上的Y800位點,從而競爭性阻斷STAT4與受體的結合。研究顯示,在高表達SOCS-3的Th2細胞中,IL-12介導的STAT4活化被強烈抑制,表明SOCS-3在Th2細胞中防止IL-12信號介導的Th1極化。除SOCS-3外,其他SOCS蛋白或蛋白酪氨酸磷酸酶也可能參與IL-12信號的調控,但SOCS-3對IL-12Rβ2的抑制作用是已知的經典機制。此外,IL-12能誘導的IFN-γ和其它下游效應也可間接反饋調節IL-12的生成,但主要的細胞內負反饋仍歸功于SOCS-3等分子的作用。
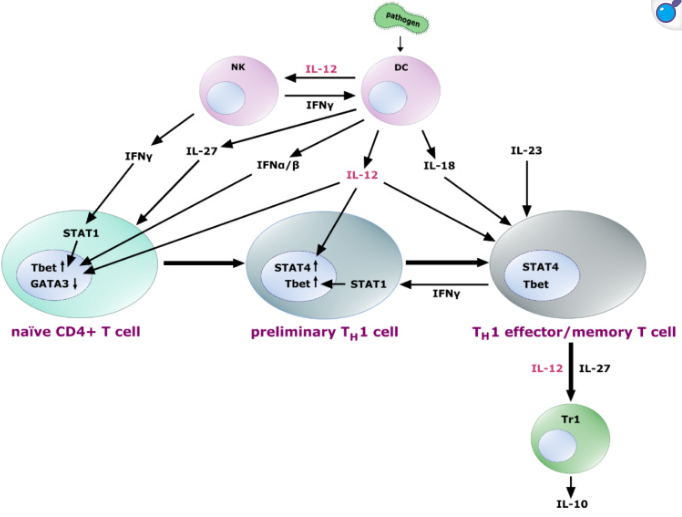
暴露于 IL-27 的幼稚 T 細胞表達 IL-12 受體異二聚體,使細胞對 IL-12 的影響敏感。IL-12 與來自 NK 細胞和反饋回路的 IFN-γ(IFN-α和 IFN-β)共同誘導轉錄因子 Tbet的上調和 GATA3的下調,從而初步實現 TH1 分化。進一步暴露于 IL-12 會導致這些早期 TH1 細胞中 STAT4 的上調,隨后它們分化為 TH1 效應 T 細胞和記憶 T 細胞。IL-18和 IL-23 有助于 TH1 細胞效應功能的固定、擴增和維持。分化的 TH1 細胞產生 IFN-γ,通過 STAT1 增強 Tbet 的表達,從而形成正反饋回路。此外,它們能夠促進 IL-10 分泌 Tr1 細胞,這一過程可能由 IL-12 和 IL-27 信號介導。
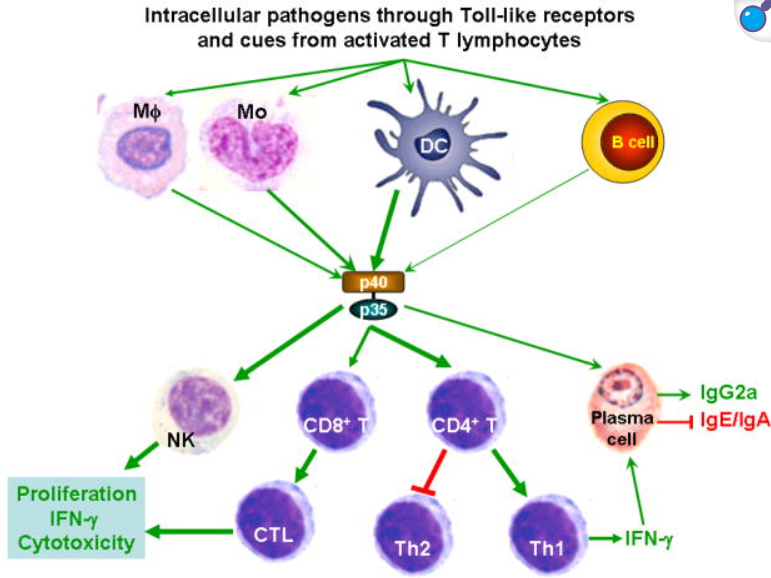
IL-12的上游誘導因素IL-12的產生主要由樹突狀細胞和巨噬細胞介導,這些抗原呈遞細胞在受到病原體相關分子模式(PAMPs)刺激后通過TLR通路激活相關轉錄因子來合成IL-12。經典的例子包括細胞毒性鏈霉菌毒素(CpG)激活TLR9、脂多糖(LPS)激活TLR4或其他TLR激活均能誘導IL-12的表達。分子機制上,TLR3/4活化時細胞內IRF-3可結合IL-12p35基因啟動子中的ISRE元件,促進p35轉錄。同時,NF-κB和AP-1等轉錄因子也參與IL-12p40亞基的啟動子激活(相關文獻顯示IRF-5等因子可誘導p40的表達,未于此重點討論)。在炎癥環境中,IFN-γ是IL-12產生的強烈增強因子:IFN-γ能誘導轉錄因子IRF-1和ICSBP(IRF-8),分別作用于IL-12p35和p40基因,形成正反饋環路。結果是IL-12激發的初始IFN-γ分泌又進一步提高后續IL-12的生成。此外,炎性細胞因子IL-18雖然自身對IFN-γ誘導作用有限,但與IL-12協同時可顯著放大IFN-γ的產生:IL-18通過STAT4和AP-1增強IFN-γ基因轉錄,特別在巨噬細胞或B細胞等非經典IFN-γ來源細胞中尤為重要。總之,IL-12的上游誘導涉及TLR-介導的NF-κB/IRF信號通路,以及IFN-γ/IL-18等炎癥因子的正反饋放大效應,確保IL-12在免疫應答中的及時釋放。
IL-12的下游生物學效應
IL-12的主要生物學作用是激活先天和適應性免疫效應細胞,從而引導免疫應答向Th1型極化。IL-12可直接刺激自然殺傷(NK)細胞和T淋巴細胞,使其大量分泌IFN-γ并增強細胞毒性。在CD4+ T細胞中,IL-12通過STAT4信號促進幼稚T細胞分化為Th1細胞,使Th1分泌表型(如高水平IFN-γ、T-bet表達)得到建立。IFN-γ反過來上調MHC分子、促進巨噬細胞殺菌效能,并促進IL-12Rβ2的表達,形成正反饋,進一步鞏固Th1極化。IL-12還能抑制Th2細胞相關因子的表達,使免疫應答更加偏向細胞介導的抗原特異性免疫。在CD8+ T細胞中,IL-12作為“信號3”參與初始激活,可促進效應CD8+ T細胞的增殖和細胞毒作用,并對其向長期記憶細胞轉化具有關鍵作用。研究表明,在抗原初次遇到早期,如果CD8+ T細胞獲得IL-12或Ⅰ型干擾素信號,其后可形成具有保護性效應的記憶T細胞群體。此外,IL-12也能間接促進B細胞的輔助活性,如通過誘導Th1細胞表位幫助B細胞產生IgG2a(未于此詳細展開)。總體而言,IL-12通過增強NK細胞和CTL功能、驅動Th1細胞分化并促進記憶T細胞生成,實現先天免疫與適應性免疫的橋接。
不同微環境中的IL-12調控與細胞選擇性效應IL-12信號的效果高度依賴于組織和炎癥微環境的特點。在感染性炎癥微環境中(如細菌、寄生蟲感染),IL-12產生通常被顯著誘導:巨噬細胞或樹突狀細胞通過TLR識別病原時大量分泌IL-12,以促進強烈的Th1反應和IFN-γ釋放。臨床上已知IL-12Rβ1缺陷會嚴重損害機體對結核分枝桿菌和沙門氏菌等胞內病原的清除能力,突顯IL-12在抗感染中的關鍵作用。相反,在慢性炎癥或腫瘤微環境中,IL-12信號經常受到抑制。許多腫瘤細胞通過激活STAT3信號通路和分泌IL-10、TGF-β等抑制性因子來抑制IL-12的生成,同時增強IL-23的產生,使免疫偏向促炎的Th17/IL-17路徑。這種IL-12/IL-23平衡的轉變利于腫瘤或慢性炎癥的持續發展。針對腫瘤免疫治療研究發現,高劑量IL-12治療往往伴隨機體產生大量IL-10反調節,但IL-12仍能極大增強腫瘤特異性CTL應答。在小鼠腫瘤模型中,IL-12給藥可顯著延緩腫瘤生長,并誘導腫瘤內部產生抑制血管生成的趨化因子(如IP-10、MIG)。臨床試驗也觀察到IL-12治療后腫瘤患者外周血和轉移灶中腫瘤特異性CD8+ CTL及記憶T細胞顯著增多。此外,IL-12的細胞選擇性效應也十分明確:例如Th2細胞高水平表達SOCS-3,可阻斷IL-12介導的STAT4信號,導致Th2對IL-12響應性很低。相反,Th1細胞則能有效響應IL-12刺激。綜上所述,IL-12信號在感染環境中被增強以促進免疫防御,而在腫瘤或慢性炎癥中常被負反饋抑制;不同免疫細胞對IL-12反應的差異則決定了其細胞選擇性效應。
IL-12在免疫治療中的應用潛力鑒于IL-12在連接先天與適應性免疫中的中心作用,它成為免疫治療的重要靶點之一。在抗腫瘤免疫方面,IL-12能通過增強CTL和NK細胞介導的殺傷以及抑制腫瘤血管生成來發揮作用。研究發現IL-12刺激的IFN-γ可上調腫瘤細胞表面MHC和ICAM-1分子,并誘導內皮細胞產生IP-10/MIG等抗血管生成因子,從而抑制腫瘤生長。小鼠實驗顯示,IL-12單獨或作為疫苗佐劑可顯著延長腫瘤模型動物生存期并提高腫瘤特異性免疫應答。例如,將IL-12基因導入腫瘤疫苗中,與常規疫苗聯合使用時比單獨使用任何一種效果更佳。然而,系統給藥IL-12常導致顯著炎癥毒性,現代策略正探索局部釋放(如腫瘤內注射)、基因治療或與其它檢查點抑制劑聯合的方案,以優化療效并減少副作用。此外,IL-12通路的調控也為治療自身免疫疾病提供了思路,針對IL-12/IL-23p40亞基的抗體(如烏司奴單抗)已用于銀屑病和克羅恩病等炎性疾病,說明IL-12信號作為調節節點在免疫治療中具有雙重意義(既可增強抗原反應亦可通過阻斷減輕自身炎癥)。總體來看,最新研究繼續揭示IL-12信號在不同病理狀態下的動態作用機制和調控手段,使其在疫苗設計、腫瘤免疫和自身免疫治療等領域擁有重要的應用前景。
參考文獻:
Ullrich, K. A., Schulze, L. L., Paap, E. M., Müller, T. M., Neurath, M. F., & Zundler, S. (2020). Immunology of IL-12: An update on functional activities and implications for disease.EXCLI journal,19, 1563–1589. https://doi.org/10.17179/excli2020-3104
Gerber, A. N., Abdi, K., & Singh, N. J. (2021). The subunits of IL-12, originating from two distinct cells, can functionally synergize to protect against pathogen dissemination in vivo.Cell reports,37(2), 109816. https://doi.org/10.1016/j.celrep.2021.109816
Liu, J., Cao, S., Kim, S., Chung, E. Y., Homma, Y., Guan, X., Jimenez, V., & Ma, X. (2005). Interleukin-12: an update on its immunological activities, signaling and regulation of gene expression.Current immunology reviews,1(2), 119–137. https://doi.org/10.2174/1573395054065115
Watford WT, Hissong BD, Bream JH, Kanno Y, Muul L, O'Shea JJ. Signaling by IL-12 and IL-23 and the immunoregulatory roles of STAT4.Immunol Rev. 2004;202:139-156. doi:10.1111/j.0105-2896.2004.00211.x
Xiao Z, Casey KA, Jameson SC, Curtsinger JM, Mescher MF. Programming for CD8 T cell memory development requires IL-12 or type I IFN.J Immunol. 2009;182(5):2786-2794. doi:10.4049/jimmunol.0803484
Goriely S, Molle C, Nguyen M, et al. Interferon regulatory factor 3 is involved in Toll-like receptor 4 (TLR4)- and TLR3-induced IL-12p35 gene activation.Blood. 2006;107(3):1078-1084. doi:10.1182/blood-2005-06-2416
Xu, M., Mizoguchi, I., Morishima, N., Chiba, Y., Mizuguchi, J., & Yoshimoto, T. (2010). Regulation of antitumor immune responses by the IL-12 family cytokines, IL-12, IL-23, and IL-27.Clinical & developmental immunology,2010, 832454. https://doi.org/10.1155/2010/832454
Floss, D. M., Klöcker, T., Schröder, J., Lamertz, L., Mrotzek, S., Strobl, B., Hermanns, H., & Scheller, J. (2016). Defining the functional binding sites of interleukin 12 receptor β1 and interleukin 23 receptor to Janus kinases.Molecular biology of the cell,27(14), 2301–2316. https://doi.org/10.1091/mbc.E14





