陰離子交換填料助力病毒載體純化效率躍升
隨著基因治療和疫苗研發領域的快速興起與發展,該領域已引起學術界和產業界的廣泛關注與高度重視。病毒載體作為基因治療和疫苗開發的核心遞送系統,其純化工藝的優化關系到終產品的關鍵質量屬性(Critical Quality Attributes, CQAs)。
在眾多純化技術中,陰離子交換層析(Anion Exchange Chromatography, AEX)因其良好的選擇性、放大性和操作可控性,已逐步成為主流病毒載體純化工藝的重要組成部分。
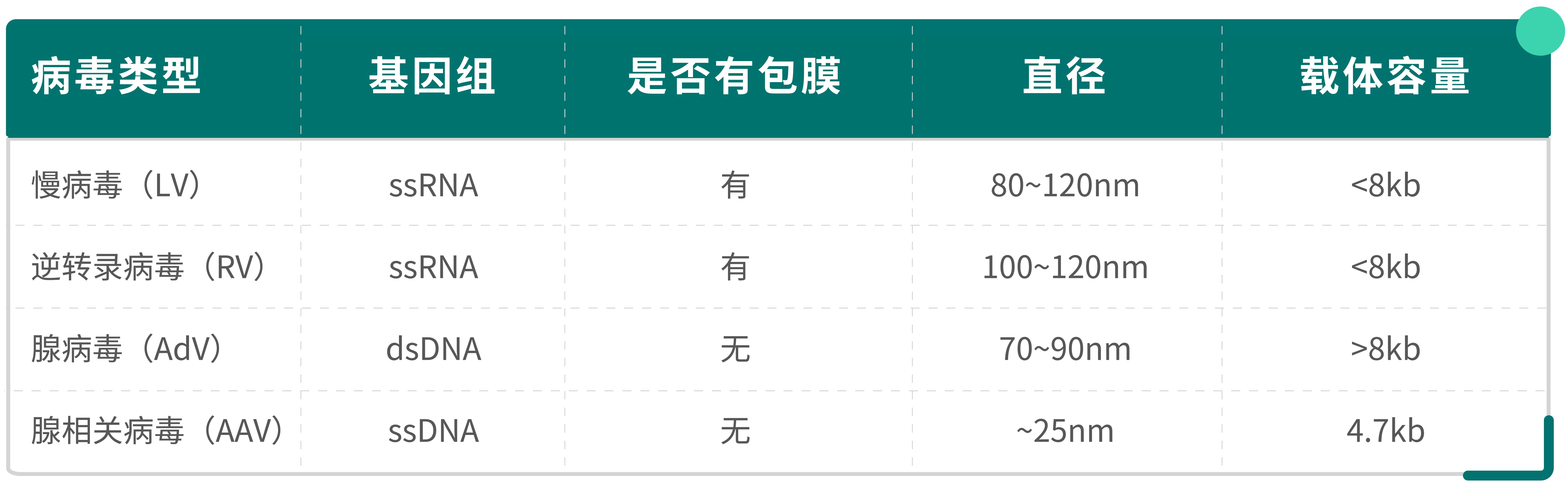
目前主流的病毒載體系統主要包括慢病毒(LV)、(γ-)逆轉錄病毒(RV)、腺病毒(AdV)和腺相關病毒(AAV)。以下為整理相關病毒載體的基本信息,根據以下信息可推薦合適的純化方案。
病毒載體基礎知識速覽目前應用最廣泛的病毒載體包括:
病毒載體純化通常包括以下幾個步驟:
• 細胞收獲:超速離心(100,000×g/2h),深層過濾(0.45μm+0.22μm串聯)。
• 核酸處理:Benzonase(50U/mL,37℃/1h)。
• UF/DF:750KDa/300kDa/100kDa濃縮過濾。
• 層析純化:陰離子交換是關鍵步驟
研究進展與典型方案一、逆轉錄病毒(RV)/慢病毒(LV)純化
逆轉錄病毒是一類具有包膜的單鏈RNA病毒,慢病毒載體是基于人類免疫缺陷病毒1型(HIV-1)改造而成的基因遞送系統,也屬于逆轉錄病毒科的重要成員。由于逆轉錄病毒載體和慢病毒載體帶負電荷,所以純化慢病毒的常規捕獲方法還是以陰離子純化方案為主。
典型層析方案示例:• 填料:Diamond Q 或 Diamond Q Mustang
• 平衡緩沖液:20mM Tris+150mM NaCl,pH7.4
• 洗脫緩沖液:20mM Tris+0.3~0.6M NaCl 梯度洗脫,pH7.4
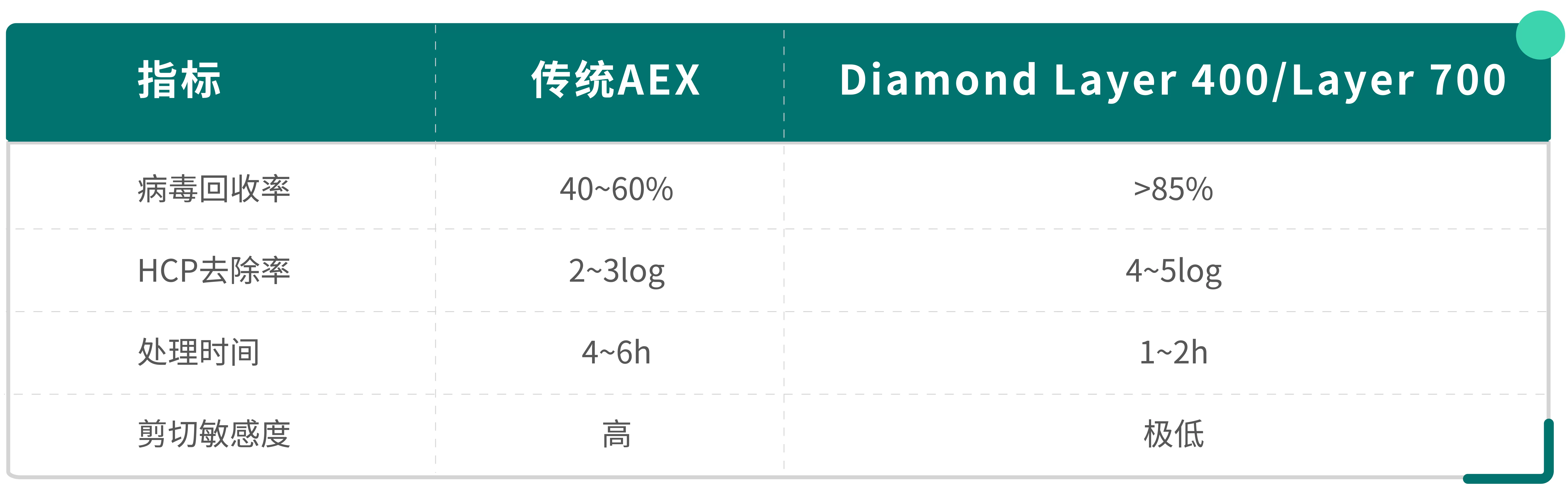
新策略推薦:采用Diamond Layer 400/Layer 700多模式層析填料,在病毒純度和回收率方面表現優異。
慢病毒載體的表面電荷異質性導致傳統陰離子交換層析存在無法選擇性捕獲的局限性。針對這一技術挑戰,可采用多模式層析填料Diamond Layer 400/Layer 700的創新純化策略,該技術基于多種層析模式實現高效純化:
層析方案示例:
• 填料:Diamond Layer 400/Layer 700
• 平衡:20mM Tris+150mM NaCl,pH7.4
• 上樣:電導率<5mS/cm,保留時間6~10min
• 洗脫:同步收集流穿峰
實驗結果:
腺病毒為無包膜的雙鏈DNA病毒,其粒徑較大(~90nm),和逆轉錄病毒和慢病毒載體純化純化方式類似,可使用陰離子層析和多模式層析。
三、腺相關病毒(AAV)純化腺相關病毒(AAV)是一種小型、非包膜的單鏈DNA病毒,屬于細小病毒科中的依賴病毒屬。其大小為25nm左右,一般還是以根據表面帶電荷情況去使用陰陽離子層析,腺相關病毒(AAV)的衣殼蛋白的等電點(PI)為5.9~6.3左右,其空殼蛋白雜質的PI會與衣殼蛋白有所差距,去除空殼蛋白一般以高分辨率的陰離子層析為主,可使用Diamond Q Mustang/Q Bestarose HP。
層析方案示例:• 填料:Diamond Q Mustang/Q Bestarose HP
• 平衡緩沖液:20mM PB pH7.4
• 洗脫緩沖液:20mM PB+50mM~500mM NaCl 梯度洗脫,pH7.4
小結:AEX層析,病毒載體純化的“強助攻”陰離子交換填料憑借其分辨率高、操作穩定、易于放大等優勢,已成為病毒載體純化中的關鍵單元操作,特別是在疫苗生產與基因治療載體制備中,發揮著不可替代的作用。隨著層析技術與填料設計的不斷迭代,AEX將持續在病毒載體工藝開發中扮演關鍵角色。
相關產品





