肝臟去唾液酸糖蛋白受體(ASGPR)的結構、功能及臨床應用
引言
肝臟去唾液酸糖蛋白受體(ASGPR)最初由Ashwell及其團隊發現,因其能夠迅速清除血液中末端為β-1,4鏈半乳糖的寡糖糖蛋白而被識別和定義。ASGPR的主要生理功能是介導血液中去唾液酸糖蛋白、脂蛋白等物質的清除,并與病毒性肝炎、肝硬化、肝癌等肝臟疾病的發生發展密切相關。ASGPR的發現及其臨床應用為肝臟疾病的診斷和治療提供了重要工具。
近年來,各國學者對ASGPR的研究取得了顯著進展,進一步提升了其臨床應用價值。
ASGPR的結構、基因與生理功能
結構
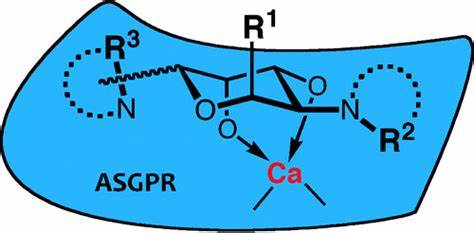
ASGPR,又稱肝凝集素,是一種異源低聚物內吞受體,主要位于肝細胞竇狀隙側的質膜表面。ASGPR屬于II型跨膜受體,包含四個功能區:胞質區、跨膜區、莖區和糖識別域(CRD)。CRD屬于C型(鈣依賴)凝集素超家族,能夠特異性結合去唾液酸的非還原半乳糖殘基和N-乙酰半乳糖胺,是ASGPR功能的核心部分。
基因
ASGPR可通過傳統親和層析法純化。從兔肝中分離出40 kDa和48 kDa兩種蛋白質(比例為2:1),而從大鼠肝臟中分離出42 kDa、49 kDa和54 kDa三種蛋白質(比例為8:1:1)。人肝細胞和肝癌細胞中僅分離出單一46 kDa的蛋白質。人HepG2細胞中存在兩種ASGPR蛋白(H1和H2),其mRNA表達量相近,但翻譯比例為主次形式(2~5:1)。H1亞基包含約40個氨基酸的N端胞質區、20個氨基酸的跨膜區、80個氨基酸的胞外莖區以及140個氨基酸的CRD。
生理功能
ASGPR在肝細胞質膜上大量表達,并具有快速內化能力,使其在清除血液中糖蛋白方面具有巨大潛力。ASGPR的天然配體包括去唾液酸血清類黏蛋白(ASOR)、去唾液酸銅藍蛋白和去唾液酸運鐵蛋白等。ASGPR通過識別半乳糖殘基或N-乙酰半乳糖胺介導ASOR的清除,這一過程具有高度特異性。
ASGPR的所有亞基均參與配體結合功能。在H2亞基缺失的情況下,H1亞基雖能正常轉運至細胞表面,但無法結合ASOR;而僅有H2亞基表達的ASGPR會被迅速降解,無法到達質膜。H1亞基的表達是H2亞基有效轉運至細胞表面的前提。
ASGPR在肝臟疾病中的作用
ASGPR的數量和活性可反映肝細胞功能狀態。在肝炎、酒精性肝病和肝癌等疾病中,ASGPR的數量和活性均受到損害。受體介導的內吞作用可能是毒性誘導肝損傷的新機制,適當的ASGPR功能對肝損傷具有保護作用。通過監測ASGPR的數量和活性變化,可預測術后肝功能代償情況。例如,李勤濤等利用ASGPR及臨床指標建立了肝儲備功能定量評估系統。
1. 乙型病毒性肝炎
HBV顆粒能與HepG2細胞結合,而阻斷ASGPR功能可顯著抑制這一過程。HBV preS1相關的病毒膜結合位點與ASGPR結合,使病毒通過ASGPR進入肝細胞。preS1與ASGPR在細胞膜上的表達區域重疊,且表達水平呈顯著正相關(Pearson相關系數為0.776,P<0.0001),表明ASGPR可能是HBV進入宿主細胞的關鍵結合伴侶。此外,ASGPR與HBV抗體形成的復合物可誘發自身免疫反應,促進急性乙型肝炎向慢性轉化,加重組織損傷。ASGPR H1亞基的CRD也是甲型肝炎病毒和馬爾堡病毒的入侵位點。
2. 慢性酒精性肝病
酒精性肝損傷與ASGPR含量降低密切相關。酒精干預可損害ASGPR的內吞過程,降低配體結合、內化和降解能力。在乙醇飼養的大鼠肝細胞中,ASGPR的配體結合、內吞和降解作用減少45%~50%。慢性酒精干預還降低了ASGPR的mRNA水平,導致其數量顯著減少,并增加肝細胞凋亡敏感性,最終發展為脂肪肝。
3. 原發性肝癌
組織微陣列技術檢測顯示,ASGPR在正常肝組織和不同分化程度的肝細胞癌(HCC)中的表達模式存在顯著差異。高分化HCC的ASGPR表達水平與正常肝組織相似,而中低分化HCC的ASGPR表達水平顯著降低。ASGPR在T細胞介導的肝損傷中具有保護作用,其缺乏會增強T細胞介導的肝炎敏感性。此外,ASGPR在血管性血友病和鏈球菌肺炎敗血癥中也有一定作用。
ASGPR的基因及藥物靶向研究
ASGPR因其跨膜引入大分子的能力,成為肝細胞或肝癌細胞靶向治療的首選目標。例如,乙酰半乳糖胺共軛的siRNA分子可特異性聚集在肝細胞中,驗證了ASGPR的靶向性。Coulstock等將IFN-α融合至ASGPR特異性抗體上,合成的融合蛋白(mIFNα2-ASGPR dAb)顯著增強了肝臟靶向性,減少了干擾素對血液和周邊組織的暴露,提高了治療的安全性和耐受性。Zhao等將蜂毒素與抗ASGPR的單鏈可變片段抗體結合,構建了重組免疫毒素,用于肝腫瘤細胞的靶向溶解。
此外,脂質魚精蛋白DNA(LPDs)和靶向性陽離子納米粒子系統(如PLGA-DOTAP-AF)等新型遞送系統也被開發用于肝細胞靶向基因治療。這些系統具有高效基因傳送能力,為肝臟疾病的治療提供了新途徑。
ASGPR應用的前景與展望
ASGPR作為肝臟定向轉移的最佳受體,為肝臟疾病的治療、肝功能檢測和基因定向表達提供了重要工具。ASGPR顯影技術可用于評估肝功能,預測手術風險并制定治療方案,但其顯影劑在穩定性和組織通透性方面仍需改進。
盡管ASGPR靶向基因藥物在肝臟疾病治療中取得了突破性進展,但其復合物的制備仍存在大小和濃度等限制。隨著生物技術的發展,這些問題有望逐步解決,ASGPR及其介導的基因和藥物轉移技術將具有廣闊的應用前景。
產品信息
參考文獻
[1] Steirer LM, Park EI, Townsend RR, et al. The AsialoglycoproteinReceptor Regulates Levels of Plasma Glycoproteins Terminatingwith Sialic Acid _2, 6-Galactose[J]. J Biol Chem, 2009, 284(6):3777-3783.
[2] Ashwell G, Harford J. Carbohydrate-specific Receptors of theLiver[J]. Ann Rev Biochem, 1982, 51: 531-554.
[3] Meier M, Bider MD, Malashkevich VN, et al. Crystal Structure ofthe Carbohydrate Recognition Domain of the H1 Subunit of theAsialoglycoprotein Receptor[J]. J Mol Biol, 2000, 300(4): 857-865.
[4] Spiess M. The Asialoglycoprotein Receptor: A Model for EndocyticTransport Receptors[J]. Biochemistry Vof, 1990, 29(43):10009-10018.
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。




