解析蛋白B7-H1(PDL1,CD274)的免疫調節作用機制
引言
在細胞免疫應答過程中,T細胞的活化與增殖需要雙信號系統的協同作用。第一信號來源于T細胞受體(TCR)對抗原提呈細胞(APC)或腫瘤細胞表面主要組織相容性復合體(MHC)的識別,而第二信號則由共刺激分子提供。B7家族作為重要的共刺激分子家族,通過與其受體CD28家族成員的相互作用,精確調控T細胞的活化狀態。目前已知的B7家族成員包括B7-1、B7-2等11種蛋白,這些分子不僅在腫瘤免疫應答中發揮關鍵作用,也在自身免疫性疾病和器官移植領域具有重要臨床價值。
B7-H1(PD-L1)
程序性死亡配體1(PD-L1),又稱B7-H1或CD274,是由CD274基因編碼的40kDa跨膜蛋白。該分子在特定生理和病理條件下表達上調,如妊娠、移植排斥、自身免疫病及惡性腫瘤等。在腫瘤微環境中,癌細胞通過表達PD-L1與T細胞表面的PD-1結合,誘導T細胞功能抑制,從而逃避免疫監視。這種免疫逃逸機制為腫瘤免疫治療提供了重要靶點。
IFN-γ信號通路的免疫調節雙重作用
干擾素γ(IFN-γ)信號通路在免疫調節中具有雙重作用。一方面,IFN-γ通過Janus激酶(JAK)-信號轉導與轉錄激活因子1(STAT1)通路激活干擾素調節因子1(IRF-1),促進PD-L1表達;另一方面,磷酸化STAT1誘導的干擾素刺激基因(ISG)可增強抗腫瘤免疫應答。值得注意的是,持續的IFN-γ刺激可能導致選擇壓力,誘發信號通路突變或表觀遺傳改變,最終削弱CD8+T細胞的腫瘤殺傷能力。
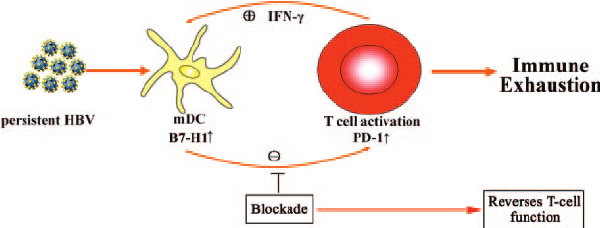
腫瘤誘導的免疫逃逸機制
大量研究表明,B7-H1/PD-1相互作用是腫瘤免疫逃逸的核心機制。雖然該通路主要抑制T細胞功能,但對樹突細胞、巨噬細胞和自然殺傷(NK)細胞等免疫細胞也具有調節作用。PD-1介導的免疫抑制涉及多種機制,包括促進細胞凋亡、誘導抑制性細胞因子、引起T細胞耗竭及調節性T細胞(Treg)增殖等。同時,B7-H1還可作為受體傳遞抗凋亡信號,增強腫瘤細胞對T細胞殺傷的抵抗能力。這種復雜的調控網絡構成了腫瘤適應性免疫抵抗的基礎。
總結
在臨床轉化方面,靶向PD-1/PD-L1的免疫檢查點抑制劑已顯著改善多種惡性腫瘤的治療效果。然而,現有療法的響應率仍局限在20%-40%之間。目前,通過免疫組織化學檢測PD-L1表達水平是指導治療決策的主要生物標志物,但其臨床應用仍面臨諸多挑戰。
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。





