毛喉素Forskolin的作用機制及在干細胞與類器官培養研究中的應用
Forskolin是一種從毛喉鞘蕊花(Coleus forskohlii)中提取出的二萜類天然產物,同時也是真核細胞腺苷酸環化酶(AC)激活劑,能提高cAMP水平。Forskolin(毛喉素,AbMole,M2191)在細胞信號傳導、代謝調控以及干細胞和類器官研究等多個領域應用廣泛。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、作用機制
使細胞內 cAMP 水平升高是 Forskolin 發揮生物學效應的關鍵基礎,高濃度的 cAMP 作為一種重要的第二信使,能夠激活蛋白激酶 A(Protein Kinase A,PKA),從而引發一系列細胞內信號傳導事件,并參與細胞分化、增殖、代謝調節、炎癥反應等多個生理過程。
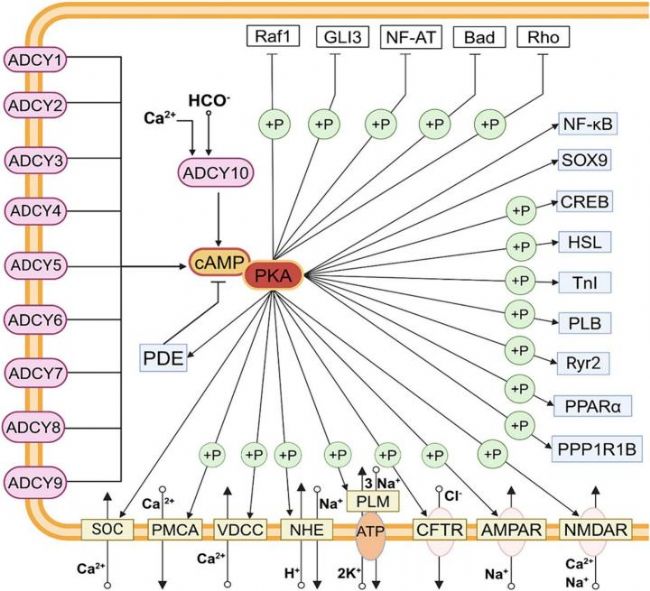

圖1. cAMP-PKA signal network
二、研究應用
1.Forskolin在干細胞和類器官研究中的應用
在干細胞和類器官研究領域,Forskolin(佛司可林,AbMole,M2191)展現出獨特的調控作用,為深入理解干細胞的命運決定和類器官的發育提供了新的研究思路和工具。在胚胎干細胞(ESCs)的培養中,Forskolin 能夠通過激活 cAMP 信號通路,影響干細胞的自我更新和分化過程。研究表明,在小鼠胚胎干細胞的培養體系中添加 Forskolin(10μM),能夠上調多能性相關基因如Oct4、Sox2和Nanog的表達,從而維持胚胎干細胞的自我更新[1]。然而,在特定的誘導條件下,Forskolin又可以促進胚胎干細胞的分化。在培養基中加入Forskolin,能夠顯著提高胚胎干細胞向神經前體細胞分化的效率,增加神經前體細胞標志物如Pax6和Nestin 的表達。這表明 Forskolin 在胚胎干細胞研究中具有雙向調控作用,其具體作用取決于細胞所處的微環境和實驗條件[2]。
在誘導多潛能干細胞(iPSCs)的研究中,Forskolin(Coleonol,AbMole,M2191)同樣具有重要的價值。Forskolin可以通過調節 cAMP 信號通路,提高體細胞重編程為 iPSCs 的效率[3]。這可能是因為 Forskolin激活的 cAMP 信號通路可以調節細胞內的表觀遺傳狀態,使體細胞更容易被重編程為多能干細胞。Forskolin 對類器官的生長和分化也具有調節作用。在腸道類器官的培養中,Forskolin可以促進腸道干細胞的增殖和分化,使類器官形成更加完整的隱窩-絨毛結構,腸道上皮細胞標志物如E -鈣粘蛋白和細胞角蛋白18的表達也顯著增加。在肝臟類器官的研究中,Forskolin可以調節肝臟類器官中肝細胞的功能成熟,促進肝臟特異性基因如白蛋白和細胞色素 P450 家族基因的表達[4]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
2.Forskolin在腫瘤研究中的應用
Forskolin(毛喉素,AbMole,M2191)對腫瘤細胞的增殖、凋亡、遷移等關鍵生物學過程產生多方面的影響。在骨髓瘤細胞U266、H929、INA-6、RPMI 8226和OPM-2 中,Forskoli表現出抑制細胞增殖的作用:當用 1-100μM 的Forskolin處理這些細胞72小時后,細胞呈現出劑量依賴性死亡[5]。在 CD77⁺ Daudi淋巴瘤細胞中,Forskolin 能夠與其他物質共同作用,通過觸發鈣離子、cAMP和神經酰胺的信號通路,誘導細胞凋亡 ,導致腫瘤細胞死亡[6]。
3.Forskolin在代謝研究中的應用
Forskolin(佛司可林,AbMole,M2191)也常用于糖代謝、脂肪代謝的研究。在糖原合成方面,Forskolin 通過提高 cAMP 水平,激活PKA,PKA可以磷酸化糖原合成酶激酶 3(GSK3),使其活性降低。在動物實驗中,給予Forskolin處理的Insulin抵抗小鼠,其血糖水平顯著降低,Insulin敏感性明顯提高,同時肝臟和肌肉組織中IRS-1的酪氨酸磷酸化水平以及 Akt 的活性均顯著增加。這些研究結果表明,Forskolin在糖代謝研究中具有重要的潛在價值,為深入理解糖代謝調控機制以及相關代謝疾病的研究提供了新的思路和方法[7]。
三、范例詳解
Cancer Lett. 2024 Oct 02;605:217284
上述文章的核心是探究胰腺導管腺癌(PDAC)對Gemcitabine耐受的發展過程,以及該過程中的動態表觀遺傳景觀,并重點研究了超級增強子及其調節作用。研究人員觀察到超級增強子的激活狀態具有很大的可塑性,這些順式元件中有相當一部分在耐受細胞中失活。此外,科研人員確定NDRG1 超級增強子(NDRG1-SE) 是Gemcitabine耐受細胞的關鍵調節因子。NDRG1-SE失活誘導 WNT/β-catenin 信號轉導激活,從而賦予PDAC細胞對Gemcitabine的耐受。 在具體實驗中,研究者使用了AbMole的多款產品,包括Gastrin-I (M9320, Abmole),重組HGF蛋白(M10352, Abmole),Forskolin (M2191, Abmole), Y27632 (M1817,Abmole), A83-01 (M5037, Abmole), Dexamethasone (M2176, Abmole), Prostaglandin E2 (M5929, Abmole), Nicotinamide (M4896, Abmole)用于培養PDO類器官。
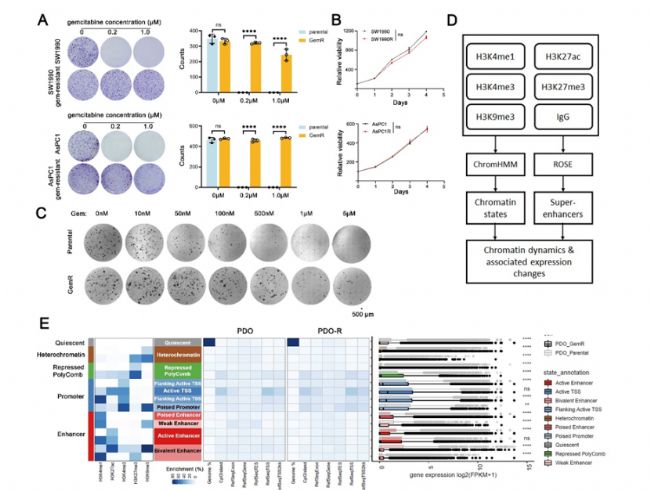
圖2. Alterations in Chromatin States in Chemo-Resistant
Pancreatic Cancer Cells[8]
參考文獻及鳴謝
[1] F. Varzideh, J. Gambardella, U. Kansakar, et al., Molecular Mechanisms Underlying Pluripotency and Self-Renewal of Embryonic Stem Cells, International journal of molecular sciences 24(9) (2023).
[2] A. Shahbazi, M. Safa, F. Alikarami, et al., Rapid Induction of Neural Differentiation in Human Umbilical Cord Matrix Mesenchymal Stem Cells by cAMP-elevating Agents, International journal of molecular and cellular medicine 5(3) (2016) 167-177.
[3] G. Scesa, R. Adami, D. Bottai, iPSC Preparation and Epigenetic Memory: Does the Tissue Origin Matter?, Cells 10(6) (2021).
[4] C. Loerch, L. P. Szepanowski, J. Reiss, et al., Forskolin induces FXR expression and enhances maturation of iPSC-derived hepatocyte-like cells, Frontiers in cell and developmental biology 12 (2024) 1383928.
[5] V. Follin-Arbelet, K. Misund, E. H. Naderi, et al., The natural compound forskolin synergizes with dexamethasone to induce cell death in myeloma cells via BIM, Scientific reports 5 (2015) 13001.
[6] Samir Taga, Karine Carlier, Zohair Mishal, et al., Intracellular Signaling Events in CD77-Mediated Apoptosis of Burkitt's Lymphoma Cells, Blood 90(7) (1997) 2757-2767.
[7] J. Y. Chen, S. Y. Peng, Y. H. Cheng, et al., Effect of Forskolin on Body Weight, Glucose Metabolism and Adipocyte Size of Diet-Induced Obesity in Mice, Animals : an open access journal from MDPI 11(3) (2021).
[8] Dianhui Wei, Lili Yuan, Xiaoli Xu, et al., Exploring epigenetic dynamics unveils a super-enhancer-mediated NDRG1-β-catenin axis in modulating gemcitabine resistance in pancreatic cancer, Cancer letters 605 (2024) 217284.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





